我国是世界上最大的棉花生产国和消费国,棉花种植面积占全球总面积30%以上[1]。其中2018—2022年新疆棉花种植面积为2.51×106 hm2,占全国总种植面积79.1%[2]。然而,新疆大部分耕地土壤盐渍化严重,棉花虽然属于中度耐盐植物,但其苗期对盐分十分敏感[3]。相比于土壤中其它盐类,钠盐对棉花生长造成的伤害最致命,过量Na+通过破坏质膜结构、降低相关酶活性等来抑制其生长,从而导致棉花产量下降[4-5]。此外,张桂玲[6]发现钠盐中阴离子的差异也会对植物生长产生影响,在相同Na+浓度下,Cl-的毒害作用大于![]() 等其它阴离子。
等其它阴离子。
基于快速叶绿素荧光诱导曲线的变化能够表征植物盐胁迫下光系统受到的伤害。张玲等[7]通过分析盐胁迫下辣椒幼苗的叶绿素荧光参数变化,提出了基于快速叶绿素荧光诱导曲线的辣椒耐盐性品种筛选策略;赵英等[8]对不同浓度NaCl溶液处理的罗汉果幼苗叶绿素荧光诱导曲线进行分析,揭示了其对盐胁迫的响应机制。近年来,不少学者提出从空间异质性出发探讨光合作用在植物叶片垂直方向上的分布特性,植物多器官间的数据融合正在成为研究趋势。李志博等[9]利用快速叶绿素荧光技术对棉花不同叶位光合特性进行分析,完成了棉花品种鉴别;FENG等[10]利用冬小麦顶1、2、4叶的叶绿素荧光参数评估了植株不同生长条件下的氮素状况。YIN等[11]将拟南芥多个叶位信息视为整体进行融合追踪,完成了对其叶片光合效率分析和动态监测。因此,实现棉苗多叶位荧光数据融合对构建稳定、精确的棉苗盐胁迫诊断模型具有指导意义。
随着深度学习的兴起,一系列算法模型逐渐应用于各类农情指标中,卷积神经网络(Convolutional neural network,CNN)是其中常见的模型结构之一[12]。CNN在识别植物的典型胁迫上有较好表现力[13-14],也衍生了不少效果优良、性能稳定的模型[15-16]。其中深度残差网络 (Deep residual network,ResNet)采用“跳跃式连接”(Shortcut connection),在多个残差学习单元堆叠的情况下能够有效避免梯度爆炸或消失[17]。然而,ResNet对长序列的特征感知与挖掘能力有所欠缺。DING等[18]指出ResNet存在有效“感受野”限制,而空洞卷积在参数计算量固定时能进一步膨胀卷积核以提取更多的特征信息[19]。因此,深度残差网络与空洞卷积结合可以在强化网络深度的同时增大各层卷积的“感受野”,有助于提升模型在长序列中的鲁棒性和拟合能力。KHOTIMAH等[20]将残差结构与空洞卷积结合搭建了SC-CAN网络,对4个小麦品种盐胁迫分类的总体准确率分别为83.08%、88.90%、82.44%和82.10%。SREEDEVI等[21]采用基于ResNet的自适应多尺度空洞卷积实现了番茄病害程度分类,最终准确率达到93.89%。
本文基于快速叶绿素荧光技术,结合相关理化指标探索棉苗的盐胁迫响应机制,结合深度残差结构和空洞卷积方法提出多叶位叶绿素荧光融合的一维深度残差空洞卷积网络(1D-deep residual dilated convolutional neural network,1D-DRDC-Net),为实现棉苗早期盐胁迫的快速无损检测提供解决方案。
试验棉苗(品种:“新陆早58号”)种植于福建农林大学旗山校区的人工气候室内,如图1所示。试验设置两组不同氯化钠(NaCl)溶液浓度梯度(100、200 mmol/L,记为S100、S200)与营养液混合处理的试验组,一组只浇灌营养液的对照组(CK)。种子播种于直径90 mm的PVC栽培盆中,播深为 5 cm。种子生长期间,由距盆栽高度1 m的全光谱LED灯(长度120 cm,功率80 W,山东桂翔光电有限公司)提供光照,环境相对湿度为40%~60%,昼夜温度为35、28℃,光周期为14、10 h。待种子萌芽后,每日21:00—22:00向每个盆中施用100 mL营养液(霍格兰改良营养液,主要成分为四水硝酸钙、硝酸钾、磷酸二氢钾)。当三叶期开始时,挑选长势一致的棉苗并分为3组,每组60盆,两个处理组分别采用NaCl浓度为100 mmol/L和200 mmol/L的营养液浇灌,CK组则仅用相同体积的营养液浇灌,每次浇灌均保证盆底有少量液体渗出。

图1 不同处理棉苗样本在盐胁迫7、14、21 d后代表性样本
Fig.1 Representative sample graphs of different treatments cottons after 7 d,14 d and 21 d of salt stress
1.2.1 生理生化指标测量
在胁迫21 d后,按照每个处理和叶位分别随机剪取5枚成熟的棉苗叶片快速保存于液氮中,用于丙二醛(Malondialdehyde,MDA)含量、超氧化物歧化酶(Superoxide dismutase,SOD)活性、过氧化物酶(Peroxidase,POD)活性测定。MDA含量测量采用硫代巴比妥酸比色法(丙二醛含量检测试剂盒,Solarbio); SOD、POD活性测定分别使用四唑盐比色法(超氧化物歧化酶活性检测试剂盒,Solarbio)和愈创木酚法(过氧化物酶活性检测试剂盒,Solarbio)[22]。计算叶片含水率时,用精度为0.001 g的电子天平称取并记录刚剪下叶片鲜质量w1,随后放入12 cm×14 cm滤纸袋中,用105℃电鼓风干燥箱杀青30 min,再将温度调至65℃干燥48 h至恒定质量,记下棉苗叶片干质量w2,计算叶片含水率wc[23]。通过分析讨论相应的生理生化指标可为快速叶绿素荧光技术得到的结果提供理论支撑。含水率计算式为
1.2.2 叶绿素荧光数据采集
在棉苗胁迫处理后第7、14、21天使用发射二极管中心波长为455 nm、强度为2 400 μmol/(m2·s)的FluorPen手持式叶绿素荧光仪(FP100型,Photon Systems Instruments,Brno,捷克)收集棉苗叶片的快速叶绿素a荧光瞬态数据,该仪器在0~600 μs范围内间隔10 μs测量一次数据,记录频率随1 s逐渐降低[23]。在胁迫7、14、21 d后,从棉苗第1片完全展开叶开始,依次向下选取4枚叶片标记为L1~L4并进行测量。每次测量前将待测棉苗进行30 min暗适应,以保证所有PSⅡ反应中心完全开放。在测量过程中,3种处理的棉苗样本分别以5盆为一组进行交替测量,以增强数据的可靠性和无偏性,最后分析讨论其OJIP曲线的差异。
为利用棉苗各叶位的快速叶绿素荧光信息实现棉苗盐胁迫诊断,结合深度残差网络结构和空洞卷积方法构建了针对一维叶绿素荧光数据的一维深度残差空洞卷积网络,又称1D-DRDC-Net,如图2(图中卷积(Convolution)和空洞卷积(Dilated convolution)的S、FN、FS及DR分别表示卷积步幅(stride)、卷积核数量(Filters num)、卷积核大小(Filter size)和空洞率(Dilated rate),N表示输入该卷积核特征图(Feature map)的深度。对于输出至Max pooling layer的Block 2,其卷积及空洞卷积的步长均为1,全连接层(Fully connection layers)包含两层神经元,数量分别为32和3)所示。1D-DRDC-Net由双层嵌套的残差连接结构组成,其结构可分解成Block 1和Block 2两类基本模块,Block 2内部分别通过一维卷积核和一维空洞卷积进行特征提取,配合外部由Block 1组成的全空洞卷积通路进一步提高模型对荧光数据的“感受视野”,强化荧光数据的特征挖掘及分析。相较于常见的深度残差结构,1D-DRDC-Net采用Swish作为激活函数以进一步强化模型特征拟合能力及训练稳定性。同时,考虑到快速叶绿素荧光数据的“强结构性”,1D-DRDC-Net仅在训练前对数据进行Zscore归一化,而在模型中未采用Batch-normalization层。因为Batch-normalization虽然能提高非结构化场景下模型对于噪声的鲁棒性,但对于数值敏感的快速叶绿素荧光数据,Batch-normalization可能会降低在较小批量(Batch size)训练下模型对于荧光强度本身的敏感性。在1D-DRDC-Net训练过程中,最小批次(Mini-batch)为8,学习率为0.000 1,使用Adam优化器对模型参数进行更新。
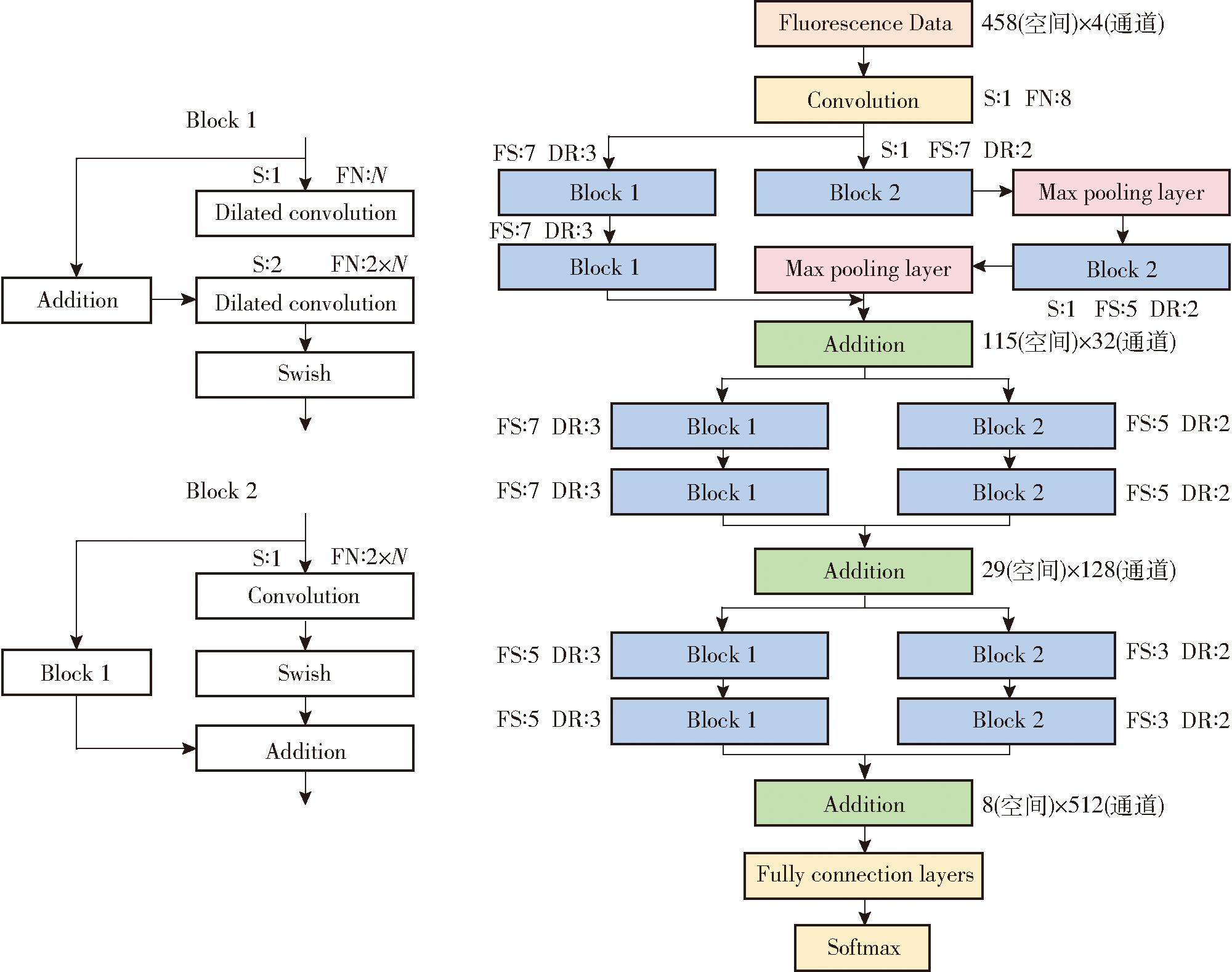
图2 1D-DRDC-Net结构示意图
Fig.2 1D-DRDC-Net structure diagram
为进一步讨论1D-DRDC-Net在处理快速叶绿素荧光数据上的优势和特点,选用支持向量机(Support vector machine,SVM)、随机森林(Random forest,RF)、反向传播神经网络(Back propagation neural network,BPNN)和双向长短期记忆网络(Bidirectional long short-term memory,Bi-LSTM)进行对比和分析。SVM作为广义线性分类器,通过求解最大边距超平面来进行回归,具有稀疏性和稳健性,在面对小数据集时有较好的准确性和鲁棒性[24]。集成学习模型RF由多个决策树组成,每个决策树都是基于随机抽样的训练样本构建而成,使得模型具有较强的抗干扰能力。Bi-LSTM由两个独立的LSTM网络组成,一个处理正向序列,一个处理反向序列,这种双向处理方式使得Bi-LSTM能够更全面地理解序列的语义特征。BPNN、Bi-LSTM和1-D CNN通过反向传播算法和梯度下降来训练网络,能最小化预测值与实际值之间的误差,学习复杂的非线性关系,但对训练数据数量有较高要求[25-26]。为进一步强化SVM、RF、BPNN的预测性能,使用贝叶斯优化算法(Bayesian optimization algorithm,BOA)更新各机器模型的超参数设定,其中SVM搜索的超参数为核方法(Kernel function,搜索范围包括:Gaussian(RBF)、Linear、Quadratic、Cubic)、核尺度(Kernel scale,搜索范围为0.001~1 000)及正则化强度(Box constraint level,搜索范围为0.001~1 000)。RF模型搜索的超参数范围包括深度限制(Maximum number of split,搜索范围为5~500)和学习器数量(Number of estimators,搜索范围为10~500)。BPNN的优化超参数包括隐藏层层数(1~3)和各隐藏层神经元数量(1~256)。BOA迭代过程中的采集函数方法为期望提升(Expected improvement)[27],最大迭代次数设置为50。Bi-LSTM隐藏单元数量固定为400。
胁迫组和对照组试验数据集分别利用KS(Kennard-stone)算法按比例2∶1划分建模集和测试集,以保证划分后的数据集在特征空间上分布均匀。为避免模型对建模集过拟合,利用KS算法再次将建模集按比例4∶1划分为训练集和验证集,用于模型超参数优化和训练早停。为了对比单一敏感叶位数据和多叶位数据在棉苗盐胁迫评估性能,在数据集划分过程中,分别以植株盐胁迫敏感叶位的荧光数据为单个样本以及将4个叶位组合后的荧光数据为单个样本进行划分。其中,植株盐胁迫敏感叶位的选取综合棉苗各叶位的生理生化指标和叶绿素荧光诱导曲线分析结果,4个叶位的光谱数据融合分别采取“叶位-通道”法和直接拼接法两种形式。多叶位荧光数据直接拼接法以特征维度方向进行长度拼接(从低叶位依次至高叶位)后,再利用KS算法划分数据集,“叶位-通道”法则考虑到深度学习中卷积过程空间(Spatial)与通道(又称深度)(Channel)的不同运算特点,对输入1D-DRDC-Net的多叶位荧光数据进行一定的格式变化处理,将不同叶位的荧光信息输入对应深度的通道中,以进一步强化1D-DRDC-Net对不同叶位耦合信息的捕捉,具体操作如图3所示。
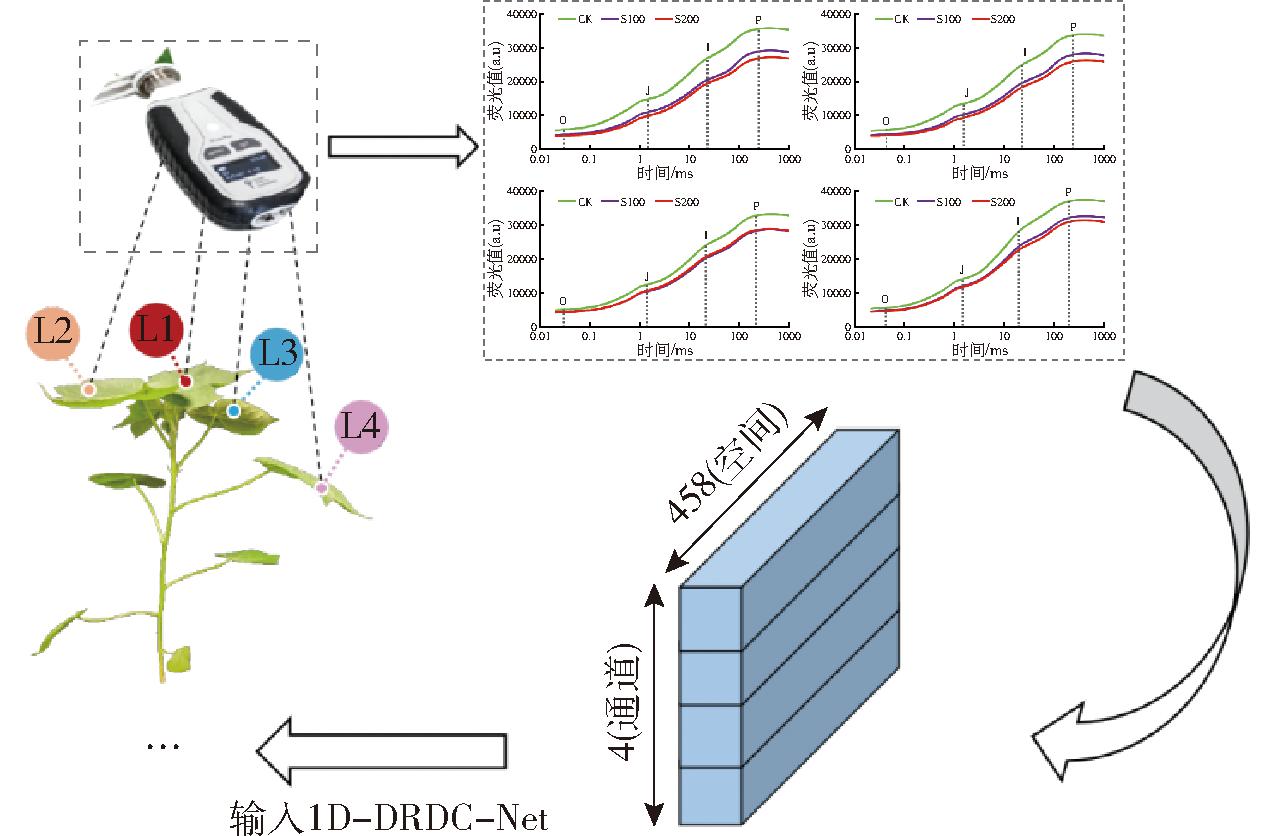
图3 L1~L4叶位数据融合示意图
Fig.3 Diagram of L1~L4 leaf position data fusion
2.1.1 盐胁迫对棉苗L1~L4生理参数的影响
植物受到逆境胁迫时会积累过量活性氧,进而导致氧化系统被破坏和膜脂过氧化[28],其自身的抗氧化酶系统能够有效降低活性氧含量以维持植物的正常生长。丙二醛是膜脂过氧化后的终产物之一,其含量是反映生物膜损坏程度的重要指标[29]。图4a(图中不同小写字母表示处理间差异显著(P<0.05))为盐胁迫21 d后棉苗各叶位的MDA含量。结果表明,随着盐分浓度增加,棉苗叶片平均总MDA含量增加,CK、S100和S200平均MDA总含量分别为45.91、69.29、72.84 nmol/g,说明盐胁迫导致棉苗细胞膜受到不同程度损伤,其中在L1上3种处理MDA含量达到显著性差异水平,在其余3个叶位CK组与胁迫组有显著差异,但胁迫组间差异不显著。与CK相比,S100和S200处理棉苗平均总含水率分别下降5.15%和4.93%(图4b),虽然在前2个叶位L1和L2上各组的下降趋势均存在显著性差异,但L1各胁迫组含水率下降量分别为L2的1.64倍和3.81倍。
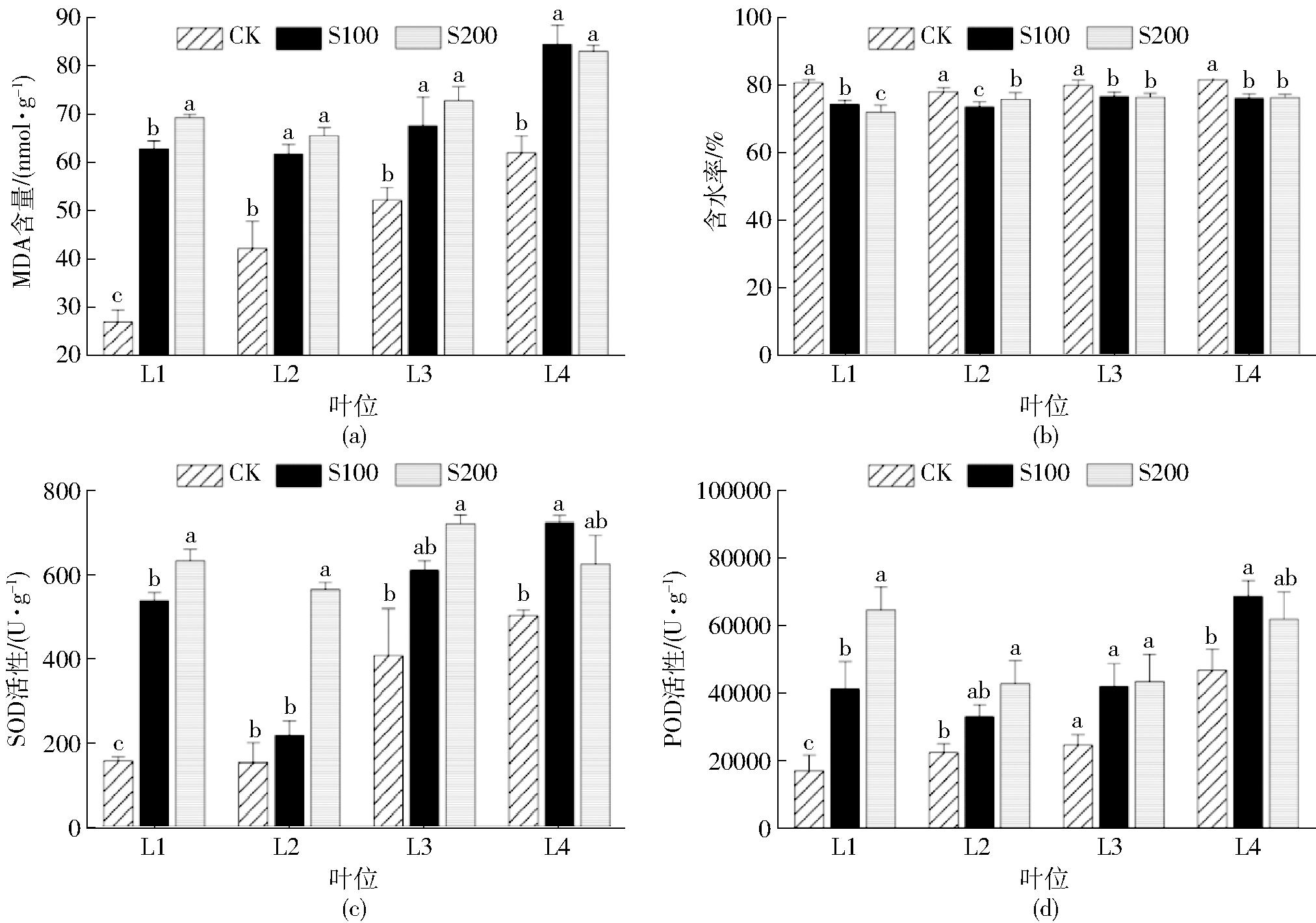
图4 盐胁迫21 d后不同叶位MDA含量、含水率、SOD活性和POD活性
Fig.4 MDA content,moisture content,SOD activity and POD activity of different leaves after 21 d of salt stress
SOD和POD作为植物保护酶系统的关键成员,能够有效调节植物体内活性氧的产生和清除,使其达到动态平衡[30]。由图4c可知,盐胁迫提高了棉苗总体SOD活性,相比于CK组,S100平均SOD活性提高217.23 U/g,S200增加331.05 U/g,说明在盐胁迫下棉苗通过提高SOD活性以减轻活性氧带来的伤害。经过单因素方差分析可以看出,3种处理间的显著性差异只存在于L1中。图4d结果表明,在盐胁迫21 d后,棉苗叶片的整体POD活性升高,S100与S200分别比CK增加24 916.5 U/g和32 086.02 U/g,说明盐胁迫使棉苗启动了自身防御机制,通过诱导POD活性增强以清除过量活性氧,其中在叶位上表现最明显的是L1,其组间差异显著(P<0.05),影响最小的为L3,未见显著差异。综上可得L1对盐胁迫的响应比其余叶位更强烈。
2.1.2 盐分胁迫下棉苗不同叶位OJIP曲线
图5为胁迫21 d后棉苗4个叶位的平均OJIP曲线,其中在L1~L4平均荧光曲线的O相(50 μs),S100比CK下降24.68%、23.37%、13.85%和14.72%,S200比CK下降31.09%、29.21%、14.53%和17.18%,O相值与天线色素(LHCII)中受光能激发的叶绿素分子所自发产生的荧光有关,而盐胁迫下O相荧光值降低表明棉苗类囊体膜上的天线色素受到了严重破坏[31]。在J相(2 ms)和I相(30 ms)处,100 mmol/L盐溶液使棉苗4个叶位荧光值分别减小24.85%、23.59%、16.12%、14.10%和23.73%、21.55%、15.99%、16.05%,200 mmol/L盐溶液使其荧光值分别减小31.69%、29.88%、13.93%、15.94%和27.40%、26.51%、14.18%、19.86%;在P相(300 ms)两个胁迫组荧光值分别下降18.53%、16.95%、13.60%、12.87%和24.37%、22.87%、13.01%、16.06%。JI与IP阶段荧光强度减少表明盐胁迫使棉苗光合电子传递链QA处电子累积,传向QB的电子速率降低,还原型PQ库和慢还原型PQ库的还原能力减弱,PSⅡ反应中心的受体侧受到伤害[32-33]。

图5 盐胁迫21 d后棉苗L1~L4的平均OJIP曲线
Fig.5 Average OJIP curves after 21 d of salt stress of L1~L4
综合来看,L3和L4两个叶位胁迫组平均荧光曲线相近,特别是在叶位L3两条曲线几乎重合,这表明盐浓度100 mmol/L和200 mmol/L处理对棉苗叶位L3带来的胁迫程度大致相同。为进一步量化4个叶位上各处理组之间的差异,用胁迫组平均荧光值减去CK组平均荧光值可消除植株生长期间正常生理活动带来的影响,然后计算两胁迫组变量矩阵间的马氏距离可进一步帮助寻找最优叶位[23]。4个叶位马氏距离分别为6.585、4.918、2.423和3.825。与平均叶绿素荧光动力学曲线结果一样,在消除棉苗生理生长因素后计算出不同叶位胁迫组之间的马氏距离结果表明,L1马氏距离最大,光谱相似性最小,其次是L2;在L3处光谱相似性最大,可能因为胁迫21 d后L3属于棉苗的功能叶,能充分获取营养物质以维持正常的生长和代谢,从而减轻盐胁迫对其的影响;L4光谱差异性小可能是其属于植株成熟叶片,在生理代谢功能方面更完善,具有更高的抗氧化损伤和离子毒害能力。
2.2.1 不同棉苗盐胁迫诊断模型对比
针对7、14、21 d后对照组及两组不同梯度(S100和S200)盐胁迫处理样本的叶绿素荧光数据建立的模型,其在三分类任务中的综合表现如表1所示。1D-DRDC-Net在测试集中取得了最优的分类效果,分类准确率和F1值分别为76.67%和76.48%,高于SVM的71.67%、71.23%、BPNN的71.67%、71.70%和Bi-LSTM的73.33%、75.80%。SVM、BPNN、RF和Bi-LSTM在训练集的表现相近,四者在训练集的准确率分别为86.67%、85.00%、85.56%和88.88%,F1值分别为86.63 %、85.03%、85.72%和89.24%,但RF在测试集的表现显著低于其它3个模型,准确率和F1值仅为62.22%和62.88%,出现了较强的过拟合问题。综合而言,对于不同时间下的多叶位荧光数据,1D-DRDC-Net表现最优,在训练集和测试集上有更强的拟合能力和泛化性。
表1 SVM、BPNN、RF、Bi-LSTM和1D-DRDC-Net分类性能
Tab.1 Classification performance of SVM,BPNN,RF,Bi-LSTM and 1D-DRDC-Nets %
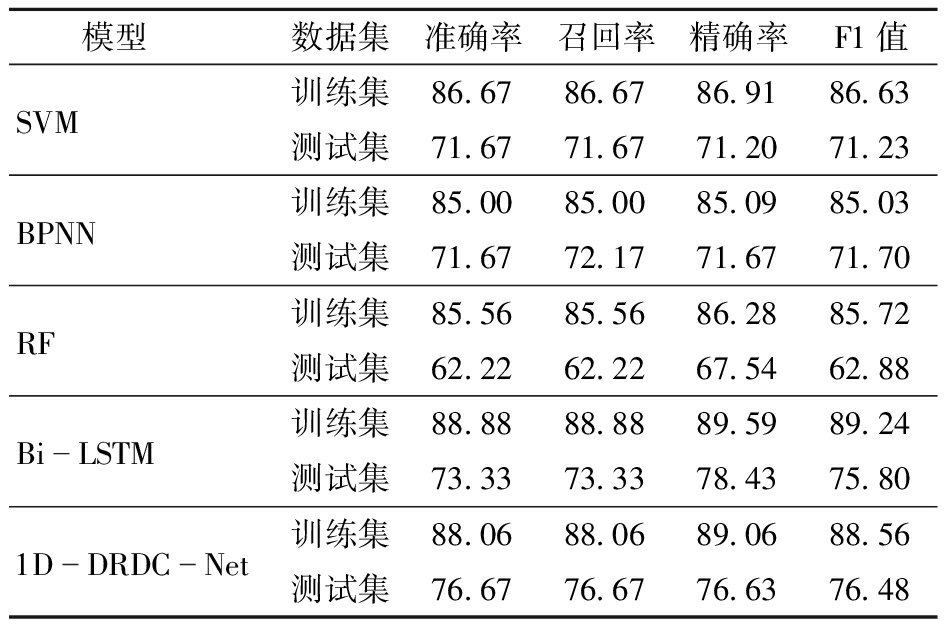
模型数据集准确率召回率精确率F1值SVM训练集86.6786.6786.9186.63测试集71.6771.6771.2071.23BPNN训练集85.0085.0085.0985.03测试集71.6772.1771.6771.70RF训练集85.5685.5686.2885.72测试集62.2262.2267.5462.88BiLSTM训练集88.8888.8889.5989.24测试集73.3373.3378.4375.801DDRDCNet训练集88.0688.0689.0688.56测试集76.6776.6776.6376.48
注:利用BOA优化后,SVM核方法、正则化强度和核尺度分别为Linear、997.66和0.98。RF模型最大深度和学习器数量分别为37和16。BPNN优化超参数包括隐藏层层数和各隐藏层神经元数量,分别为1和190。
2.2.2 不同数据输入对模型性能的影响
综合前文盐分胁迫对棉苗不同叶位的影响,单叶位荧光信息选用盐胁迫敏感叶位L1。基于单叶位荧光诱导数据和两种不同的多叶位荧光诱导数据融合方式构建的1D-DRDC-Net模型,其性能如表2所示。可以发现,无论采用何种荧光数据的融合方式,基于多叶位信息的1D-DRDC-Net的预测性能更优,“叶位-通道”方法与直接拼接法在测试集的总体准确率分别为76.67%和73.89%,较基于单叶位信息的67.78%提高8.89、6.11个百分点。这一结果说明棉苗多叶位荧光信息的融合能显著提高盐胁迫诊断模型的性能。进一步对比“叶位-通道”方法和直接拼接法,在7、14、21 d的测试集样本数据中,提出的“叶位-通道”法准确率分别提高2.04、5.00、1.02个百分点,总体准确率提高2.78个百分点。相较于直接进行数据拼接,基于“叶位-通道”的荧光数据融合方法使深度学习模型能更敏感地把握植株整体信息,从而整体优化模型性能。
表2 基于棉苗单叶位荧光数据及两种多叶位荧光数据融合方法训练后1D-DRDC-Net在不同胁迫时长测试集中性能
Tab.2 Performance of 1D-DRDC-Net based on a single leaf-based induced fluorescent data and two different fusion forms of multi-leaf-induced fluorescent data %
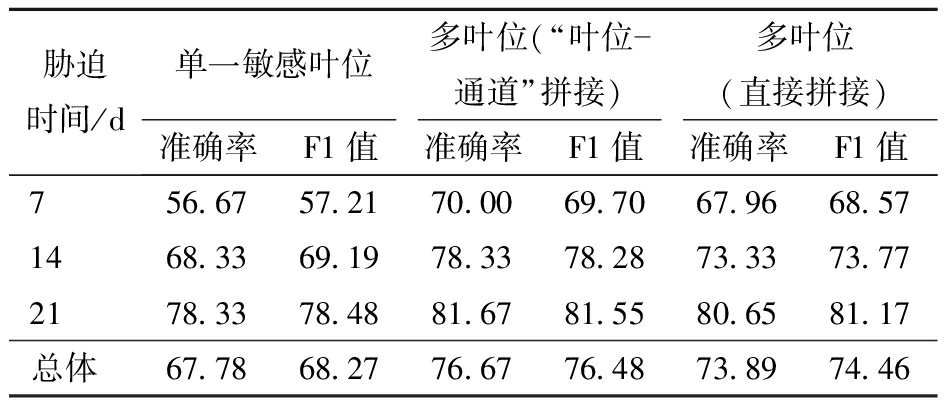
胁迫时间/d单一敏感叶位多叶位(“叶位通道”拼接)多叶位(直接拼接)准确率F1值准确率F1值准确率F1值756.6757.2170.0069.7067.9668.571468.3369.1978.3378.2873.3373.772178.3378.4881.6781.5580.6581.17总体67.7868.2776.6776.4873.8974.46
注:综合上文不同叶位下的生理指标和快速叶绿素荧光分析,单叶位信息采用最敏感的叶位L1,对荧光数据进行长度方向上的拼接时,按照叶位由低至高进行排列。
2.2.3 模型不同结构消融实验对比
为进一步讨论1D-DRDC-Net不同设计点在处理叶绿素荧光诱导数据上的优劣,就1D-DRDC-Net的结构特点进行了消融对比,如表3所示。取消Block 1中跳跃连接、将空洞卷积核替换成普通卷积核或去除Block 2均对模型在测试集的精度产生了一定的负面影响。相较于仅使用常规卷积核,一维空洞卷积方法有效提高了模型在测试集中的泛化性,替换掉空洞卷积核后,模型虽然在训练集拟合精度上有所提升,但测试集精度下降2.78个百分点,造成上述情况的原因是空洞卷积核通过增加空洞率可以扩大“感受野”,有助于获取多尺度信息,同时由于其参数共享特性,在数据量较小的情况下可以更好地泛化到测试集,从而有效避免局部噪声序列过拟合的问题。针对一维快速叶绿素荧光数据这类型的长时间序列,跳跃连接能够更好地捕捉数据之间的依赖关系,使信息更自由地流动,提高特征的复用性,其中Block 2中嵌套Block 1的设计进一步结合了空洞卷积与跳跃连接的优势。因此,在取消跳跃连接或去除Block 2后,模型在训练集和测试集中的表现皆有所下降,其中去除Block 2对模型在测试集中的负面影响更加显著。最后,同时去除跳跃连接、Block 2和空洞卷积结构后,模型在测试集中的准确率和F1值仅为68.33%和69.02%,相较于原模型下降8.34、7.46个百分点。可见空洞卷积结合残差结构在一定程度上强化了CNN模型的鲁棒性和拟合能力。
表3 去除模型中不同结构对模型在训练集及预测集精度的影响
Tab.3 Remove influence of different structures in model on accuracy of training set and prediction set %
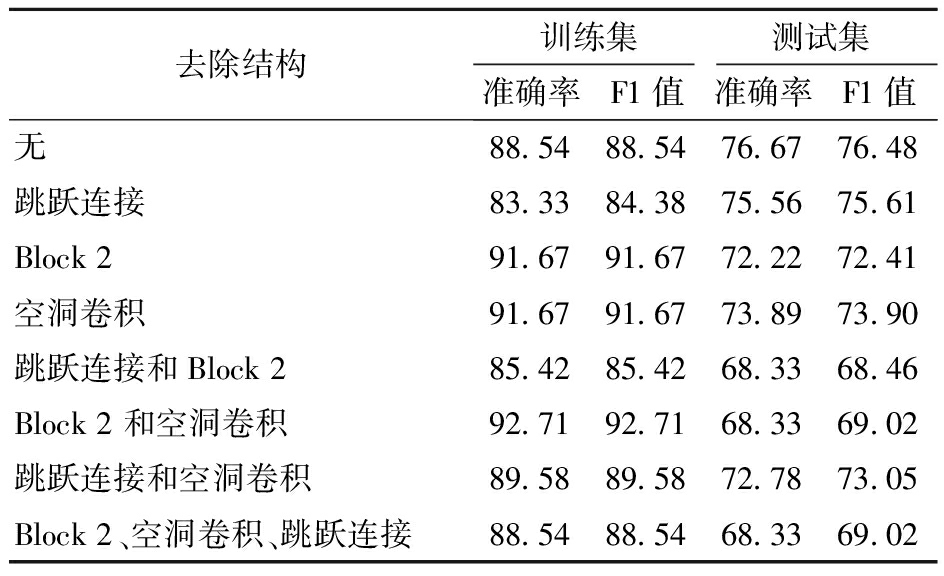
去除结构训练集测试集准确率F1值准确率F1值无88.5488.5476.6776.48跳跃连接83.3384.3875.5675.61Block291.6791.6772.2272.41空洞卷积91.6791.6773.8973.90跳跃连接和Block285.4285.4268.3368.46Block2和空洞卷积92.7192.7168.3369.02跳跃连接和空洞卷积89.5889.5872.7873.05Block2、空洞卷积、跳跃连接88.5488.5468.3369.02
注:移除空洞卷积核时,利用相同核大小、步幅的普通卷积进行替换。
2.2.4 棉苗盐胁迫诊断模型结果
1D-DRDC-Net在不同胁迫时间测试集样本中的混淆矩阵如图6所示,可以发现模型误差的主要来源为CK与S100之间以及S100与S200之间的误判。CK和S100之间的预测误差主要集中在胁迫前中期,而S100和S200之间的预测误差在各胁迫时间都比较高,考虑到植株间个体耐盐水平存在一定差异,在仅考虑是否存在盐胁迫时,将S100和S200统一划归为盐胁迫类别,1D-DRDC-Net验证准确率在7、14、21 d后的测试集中达到83.33%、88.33%、和95.00%,可就是否存在盐胁迫实现较高的诊断精度。

图6 1D-DRDC-Net在7、14、24 d测试集预测类别和真实类别的混淆矩阵
Fig.6 1D-DRDC-Net verified confusion matrix of predicted class and true class at 7 d,14 d and 24 d
(1)通过分析棉苗叶片的OJIP曲线,并结合相关生理生化指标(MDA、含水率、SOD、POD),可知盐胁迫会导致其叶片类囊体膜损坏,PSⅡ中心能量转换和吸收效率降低,此时棉苗会启动自身保护机制诱导相关抗氧化酶活性升高,以维持自身正常生理活动。在垂直方向上,上部分叶片最先对盐胁迫做出反应,其中对胁迫最敏感的叶位为L1,中下部叶片因代谢能力更加完善受到的影响较小。
(2)基于“叶位-通道”的荧光数据融合策略能够有效提升模型的拟合能力和鲁棒性,基于“叶位-通道”的1D-DRDC-Net对各胁迫时间下CK、S100、S200的棉苗盐胁迫总体诊断准确率为76.67%,F1值为76.48%,相较于只用单一敏感叶位构建的模型准确率提高8.89个百分点,F1值提高8.21个百分点。针对叶绿素荧光数据设计的结合残差模块和空洞卷积核结构的1D-DRDC-Net模型在预测性能上表现最佳,优于RF、SVM、BPNN和Bi-LSTM模型,同时利用消融实验证明了该模型设计的实用性。融合多叶位荧光信息构建的1D-DRDC-Net模型在盐胁迫7、14、21 d后,对棉苗是否受到胁迫的诊断精度达到83.33%、88.33%和95.00%,为实现棉苗盐胁迫精准无损诊断提供了新思路和技术手段。
[1] 喻树迅.我国棉花生产现状与发展趋势[J].中国工程科学,2013,15(4):9-13.YU Shuxun.Present situation and development trend of cotton production in China[J].Strategic Study of CAE,2013,15(4):9-13.(in Chinese)
[2] 邵晶晶,李鹏程,郑苍松,等.盐胁迫对干播湿出棉花出苗率和苗期生长发育的影响[J].棉花学报,2023,35(4):288-301.SHAO Jingjing,LI Pengcheng,ZHENG Cangsong,et al.Effects of salt stress on emergence rate and development of cotton seedlings under dry-sowing and wet-emergence planting mode[J].Cotton Science,2023,35(4):288-301.(in Chinese)
[3] 董元杰,陈为峰,王文超,等.不同NaCl浓度微咸水灌溉对棉花幼苗生理特性的影响[J].土壤,2017,49(6):1140-1145.DONG Yuanjie,CHEN Weifeng,WANG Wenchao,et al.Effects of brackish water irrigation under different NaCl concentrations on physiological characteristics of cotton seedlings[J].Soils,2017,49(6):1140-1145.(in Chinese)
[4] 孙文君,江晓慧,付媛媛,等.盐分胁迫对棉花幼苗叶片叶绿素荧光参数的影响[J].灌溉排水学报,2021,40(7):23-28,121.SUN Wenjun,JIANG Xiaohui,FU Yuanyuan,et al.The effects of salt stress on chlorophyll fluorescence of cotton seedling leaves[J].Journal of Irrigation and Drainage,2021,40(7):23-28,121.(in Chinese)
[5] 方怡然,薛立.盐胁迫对植物叶绿素荧光影响的研究进展[J].生态科学,2019,38(3):225-234.FANG Yiran,XUE Li.Research advances in the effect of salt stress on plant chlorophyll fluorescence[J].Ecological Science,2019,38(3):225-234.(in Chinese)
[6] 张桂玲.渗透胁迫和离子毒害对转Bt基因棉幼苗生长及离子分布的影响[J].热带亚热带植物学报,2012,20(2):156-162.ZHANG Guiling.Effects of osmotic stress and ionic toxicity on growth and ion allocation in transgenic Bt cotton seedlings[J].Journal of Tropical and Subtropical Botany,2012,20(2):156-162.(in Chinese)
[7] 张玲,王华,周静,等.NaCl胁迫对两个辣椒品种幼苗叶绿素荧光参数等生理特性的影响[J].浙江农业学报,2017,29(4):597-604.ZHANG Ling,WANG Hua,ZHOU Jing,et al.Effects of NaCl stress on chlorophyll fluorescence characteristics and physiological characteristics in seedlings of two pepper cultivars[J].Acta Agriculturae Zhejiangensis,2017,29(4):597-604.(in Chinese)
[8] 赵英,吴敏,邓平,等.盐胁迫对罗汉果幼苗生长和叶绿素荧光参数的影响[J].中国南方果树,2021,50(2):103-107.ZHAO Ying,WU Ming,DENG Ping,et al.Effects of salt stress on growth and chlorophyll fluorescence characteristics of Siraitia grosvenorii(Swingle)C.jeffrey seedlings[J].South China Fruits,2021,50(2):103-107.(in Chinese)
[9] 李志博,魏亦农,张荣华,等.棉花不同叶位叶绿素荧光特性初探[J].棉花学报,2005,17(3):189-190.LI Zhibo,WEI Yinong,ZHANG Ronghua,et al.Primary studies on chlorophyll fluorescence characteristics of cotton leaves at different leaf position[J].Cotton Science,2005,17(3):189-190.(in Chinese)
[10] FENG W,HE L,ZHANG H Y,et al.Assessment of plant nitrogen status using chlorophyll fluorescence parameters of the upper leaves in winter wheat[J].European Journal of Agronomy,2015,64:78-87.
[11] YIN X,LIU X,CHEN J,et al.Joint multi-leaf segmentation,alignment,and tracking for fluorescence plant videos[J].IEEE Transactions on Pattern Analysis and Machine Intelligence,2018,40(6):1411-1423.
[12] 翁海勇,李效彬,肖康松,等.基于Mask R-CNN的柑橘主叶脉显微图像实例分割模型[J].农业机械学报,2023,54(7):252-258,271.WENG Haiyong,LI Xiaobin,XIAO Kangsong,et al.Instance segmentation model for microscopic image of citrus main leaf vein based on Mask R-CNN[J].Transactions of the Chinese Society for Agricultural Machinery,2023,54(7):252-258,271.(in Chinese)
[13] HE Y,ZENG H,FAN Y,et al.Application of deep learning in integrated pest management:a real-time system for detection and diagnosis of oilseed rape pests[J].Mobile Information Systems,2019,2019:1-14.
[14] DECHANT C,WIESNER-HANKS T,CHEN S,et al.Automated identification of northern leaf blight-infected maize plants from field imagery using deep learning[J].Phytopathology,2017,107(11):1426-1432.
[15] KAMAL K C,YIN Z,LI B,et al.Transfer learning for fine-grained crop disease classification based on leaf images[C]∥2019 10th Workshop on Hyperspectral Imaging and Signal Processing:Evolution in Remote Sensing (WHISPERS).IEEE,2019:1-5.
[16] KC K,YIN Z,WU M,et al.Depthwise separable convolution architectures for plant disease classification[J].Computers and Electronics in Agriculture,2019,165:104948.
[17] 姜红花,杨祥海,丁睿柔,等.基于改进ResNet18的苹果叶部病害多分类算法研究[J].农业机械学报,2023,54(4):295-303.JIANG Honghua,YANG Xianghai,DING Ruirou,et al.Identification of apple leaf diseases based on improved ResNet18[J].Transactions of the Chinese Society for Agricultural Machinery,2023,54(4):295-303.(in Chinese)
[18] DING X,ZHANG X,ZHOU Y,et al.Scaling up your kernels to 31×31:revisiting large kernel design in CNNs[C]∥2022 IEEE/CVF Conference on Computer Vision and Pattern Recognition (CVPR),2022:11953-11965.
[19] 孙俊,何小飞,谭文军,等.空洞卷积结合全局池化的卷积神经网络识别作物幼苗与杂草[J].农业工程学报,2018,34(11):159-165.SUN Jun,HE Xiaofei,TAN Wenjun,et al.Recognition of crop seedling and weed recognition based on dilated convolution and global pooling in CNN[J].Transactions of the CSAE,2018,34(11):159-165.(in Chinese)
[20] KHOTIMAH W N,BOUSSAID F,SOHEL F,et al.SC-CAN:spectral convolution and channel attention network for wheat stress classification[J].Remote Sensing,2022,14(17):4288.
[21] SREEDEVI A,SRINIVAS K.Implementation of adaptive multiscale dilated convolution-based ResNet model with complex background removal for tomato leaf disease classification framework[J].Signal,Image and Video Processing,2024,18(3):2007-2017.
[22] LI J,ZENG H,HUANG C,et al.Noninvasive detection of salt stress in cotton seedlings by combining multicolor fluorescence-multispectral reflectance imaging with EfficientNet-OB2[J].Plant Phenomics,2023,5:0125.
[23] 伍明杨.融合叶绿素a荧光与反射光谱的芦竹耐盐性快速评价方法研究[D].福州:福建农林大学,2024.WU Mingyang.Rapid evaluation of salt tolerance of A.donax.L using chlorophyll a fluorescence combined with reflection spectrum[D].Fuzhou:Fujian Agriculture and Forestry University,2024.(in Chinese)
[24] SCHOLKOPF B.Making large scale SVM learning practical[J].Advances in Kernel Methods:Support Vector Learning,1999,28:41-56.
[25] ZHAO W,MA H,ZHOU C,et al.Soil salinity inversion model based on BPNN optimization algorithm for UAV multispectral remote sensing[J].IEEE Journal of Selected Topics in Applied Earth Observations and Remote Sensing,2023,16:6038-6047.
[26] KIRANYAZ S,AVCI O,ABDELJABER O,et al.1D convolutional neural networks and applications:a survey[J].Mechanical Systems and Signal Processing,2021,151:107398.
[27] FRAZIER P I.A tutorial on Bayesian optimization[J].arXiv preprint arXiv:1807.02811,2018.
[28] 张昆,李明娜,曹世豪,等.白颖苔草对不同浓度NaCl胁迫的响应及其耐盐阈值[J].草业科学,2017,34(3):479-487.ZHANG Kun,LI Mingna,CAO Shihao,et al.Response of Carex rigescens to different NaCl concentrations and its salinity threshold calculation[J].Pratacultural Science,2017,34(3):479-487.(in Chinese)
[29] 石婧,刘东洋,张凤华.棉花幼苗对盐胁迫的生理响应与耐盐机理[J].浙江农业学报,2020,32(7):1141-1148.SHI Jing,LIU Dongyang,ZHANG Fenghua.Physiological response and salt tolerance mechanism of cotton seedlings to salt stress[J].Acta Agriculturae Zhejiangensis,2020,32(7):1141-1148.(in Chinese)
[30] 芦丽娜,谢佳佳,王庆文,等.NaCl胁迫下交替呼吸途径对叶绿素含量及其荧光特性的影响[J].西北植物学报,2017,37(6):1175-1181.LU Li’na,XIE Jiajia,WANG Qingwen,et al.Effect of alternative respiratory pathway on chlorophyll content and chlorophyll fluorescence characteristics under NaCl stress[J].Acta Botanica Boreali-Occidentalia Sinica,2017,37(6):1175-1181.(in Chinese)
[31] ZUSHI K,MATSUZOE N.Using of chlorophyll a fluorescence OJIP transients for sensing salt stress in the leaves and fruits of tomato[J].Scientia Horticulturae,2017,219:216-221.
[32] KHAN N,ESSEMINE J,HAMDANI S,et al.Natural variation in the fast phase of chlorophyll a fluorescence induction curve (OJIP) in a global rice minicore panel[J].Photosynthesis Research,2021,150(1-3):137-158.
[33] DABROWSKI P,BACZEWSKA A H,PAWLU KIEWICZ B,et al.Prompt chlorophyll a fluorescence as a rapid tool for diagnostic changes in PSⅡ structure inhibited by salt stress in Perennial ryegrass[J].Journal of Photochemistry and Photobiology B:Biology,2016,157:22-31.
KIEWICZ B,et al.Prompt chlorophyll a fluorescence as a rapid tool for diagnostic changes in PSⅡ structure inhibited by salt stress in Perennial ryegrass[J].Journal of Photochemistry and Photobiology B:Biology,2016,157:22-31.