干旱是影响作物产量的主要因素,全球大约50%的小麦产区遭受干旱胁迫[1],产量减幅可达10%~70%[2]。从全球农业发展来看,水资源短缺日益加剧[3],世界小麦总体产量却以平均速度3.4%增长[4],其中很大程度上与选育抗旱性品种有直接的联系[5]。因此,对小麦品种进行抗旱性鉴定和筛选抗旱性强的品种,对保障我国粮食安全和农业可持续发展具有重要意义[6]。
根系是植物重要的结构功能器官,对地上部分起到支持固定作用,是植物吸收水分和养分的主要通道,同时也是生长调节激素的重要合成场所[7-10]。根系系统结构(Root system architecture,RSA)对根系的物理和生理功能发挥有重要影响,RSA被定义为根系的外部轮廓形状和根系内部的空间排布特征,它是动态的,由基因调控并受外部环境(土壤水分、温度、养分、pH值和微生物群落)的影响[11-15]。根系结构与作物的抗旱能力息息相关,通过一系列的根系表型指标对RSA进行描述,例如根面积、总根长、根深、根宽、根宽深比、根密度等,获取量化的根系表型,可为研究根系的节水抗旱提供关键根系构型数据支持,从而缓解环境变化和耕地减少对粮食增产的压力[16-20]。
根系生长在不透明的土壤中,使得根系表型的获取难度要远远大于地上植株表型,成为优良株型育种和功能基因组进一步研究的阻碍[21-22]。随着相关技术的进步,表型获取方法在过去几十年中取得了显著的发展,X射线计算机断层成像技术(X-ray computed tomography,X-CT)和探地雷达扫描技术(Ground penetrating radar,GPR)根据根系与基质对特定电磁波长吸收差异,通过非侵入性扫描获取原位根系,但实验室设施建立条件和设备维护成本较高[23-24]。为了获取根系实时生长的图像,IYER-PASCUZZI等[25]和CLARK等[26]分别把水稻幼苗种植于琼脂和结冷胶中,通过透明的琼脂和结冷胶培养基质,能够直接地观察分析水稻幼苗根系形态和生长状况,但由于缺乏土壤理化环境和根系与土壤微生物之间的交互作用,所以与传统的田间种植存在差异。根窗法是通过安装在土壤中的透明窗口来观测根系动态生长的非侵入性技术,受到根窗安装位置限制,只能观察到窗口所涵盖根系部分[27]。根盒法是常用的根系无损观测方法,通过将被观测作物种植于扁平透明的根盒容器中实现成像[28],其成本低且检测速度快,适用于高通量作物根系表型成像研究[29]。
本研究利用土培根盒法进行小麦干旱胁迫实验,采集18个时间点的根系时序图像,设计一套基于深度学习的根系图像处理与分析流程,针对土培根盒法根系被土壤基质遮挡引起的断根问题,提出融合断根检测及修复的两阶段断根修复方法,提取并分析不同水分处理环境下的小麦根系的6个表型特征,为小麦品种的抗旱性评估和筛选提供支持。
本研究选取43个小麦品种作为实验对象,种子由中国科学院遗传与发育生物学研究所和中国科学院遗传与发育生物学研究所农业资源研究中心提供。
选择籽粒饱满的种子,经过表面消毒并在4℃恒温箱中进行2 d层积处理,接着把种子放入底部铺设湿润脱脂棉球的培养皿中,在20℃恒温环境下放置35 h,于2022年11月15日将萌发后的种子播种到根盒中,每组设置2个重复。
小麦种植于湖北省武汉市华中农业大学作物表型平台(30°28′N,114°21′E)的根系观测系统,根盒的高度60 cm,宽度30 cm,厚度1.5 cm,根盒均以低氮壤土和砂土等体积混合作为基质。低氮土有机质含量为15.5 g/kg,全氮含量为0.8 g/kg,全磷含量为0.7 g/kg,全钾含量为16.6 g/kg,碱解氮含量为55.5 mg/kg,速效磷含量为2.9 mg/kg,速效钾含量为97.0 mg/kg,pH值为6.9。低氮壤土经粉土机处理后,与砂土以体积比1∶1混合后放入搅拌机,同时放入底肥(1 kg土加入尿素0.3 g、磷酸二氢钾0.192 3 g、氯化钾0.133 8 g),搅拌均匀后将其灌入根盒,每个根盒约装填3 500 g基质。
平台配备电动大棚和滴灌系统。电动大棚由人工操作遥控器实现开关,打开用于阳光照射,降水时关闭,防止降水对水分定量研究试验造成影响。滴灌系统用于精确给每一根盒定量浇水,主要由电源控制柜、增压泵、施肥桶、施肥桶搅拌机、U-PVC给水管、PE毛管、2 L/h的Netafim稳流滴头等组成,人工调节球阀实现滴灌的开关。
对照组与干旱组同时浇水,但二者浇水时长不同。干旱组时长为3 min,对照组浇水时长为7 min,浇水频率受气温和空气湿度影响,4~10 d浇水1次,浇水记录见表1。每个根盒均使用出水流量为2 L/h的Netafim稳流滴头灌溉。
表1 小麦实验浇水方案
Tab.1 Experimental wheat watering scheme
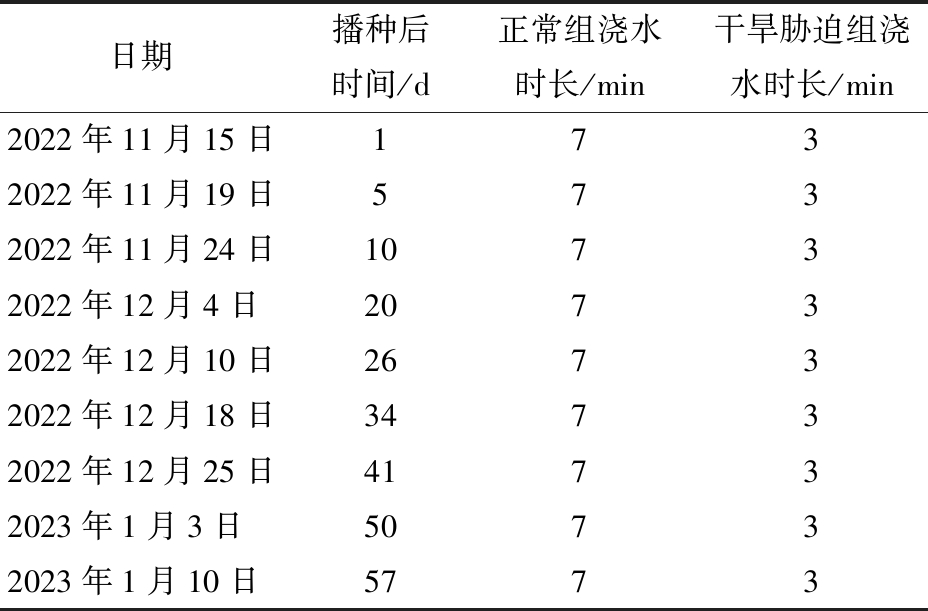
日期播种后时间/d正常组浇水时长/min干旱胁迫组浇水时长/min2022年11月15日1732022年11月19日5732022年11月24日10732022年12月4日20732022年12月10日26732022年12月18日34732022年12月25日41732023年1月3日50732023年1月10日5773
小麦根系生长时序图像采集时间为2022年11月23日—2023年1月19 日,拍摄设备为Basler-acA5472型工业相机,镜头型号为HN-1624-20M-C1/1X,位数为24位,图像为PNG格式。图1是根盒小麦培养系统与根系图像采集小车示意图,小车放置在不锈钢轨道上,相机固定于可沿轴移动的小车模组上,相机移动方向与根盒玻璃平面呈平行关系,镜头所在直线与根盒玻璃平面呈垂直关系,通过小车的启停运动配合根盒架子的推拉实现根系表型图像采集。相机镜头距离根盒约80 cm,采集的图像分辨率为5 496像素×3 672像素。为避免玻璃面反光对图像造成影响,将拍摄时间选定为夜间。小麦播种时间为11月中旬,白天温度在25℃以上,小麦根系生长较快,拍摄频率为2 d/次;约1个月后进入冬季,温度降低,小麦根系生长放缓,拍摄频率为3 d/次。每次采集172个根盒的根系图像,一共采集18个时间点,共3 096幅根系图。
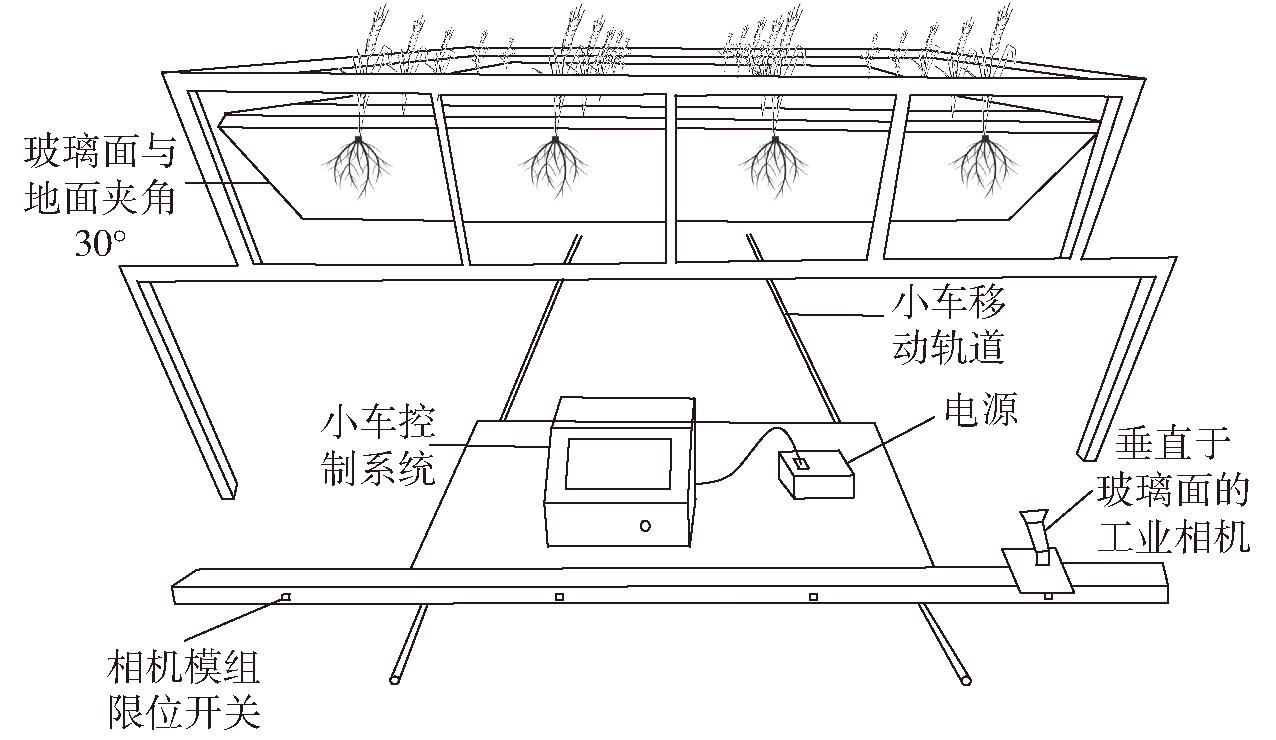
图1 根盒小麦培养系统与根系图像采集小车示意图
Fig.1 Schematic of root box wheat culture system and root image acquisition cart
对于采集的根盒原图,其处理流程如图2所示。首先分割根盒的玻璃面,对分割出的玻璃面进行透视矫正后,进行图像增强并分割根系;接着针对土培根盒法根系存在的断根现象,提出了一种先检测断根位置,再根据位置信息修复断根的两阶段根系修复方法;最后使用特征提取程序提取根系表型特征。

图2 图像处理流程图
Fig.2 Image processing flowchart
1.3.1 图像预处理
实验采集的根系图像包含两部分,玻璃面部分和需剔除的背景部分。拍摄根系图像时,根盒与小车的位置均不固定,根盒在推拉时会产生位移偏差,因此小车拍摄到的图像存在不同的畸变,对图像的品质造成影响。针对这一问题,本研究提出了一种图像预处理的方法,能批量实现玻璃面保留和背景去除,并对玻璃面图像进行矫正,利用深度学习图像增强网络对矫正后的玻璃面增强,提升图像品质。具体包含2个步骤:
(1)玻璃面分割与透视矫正:随机挑选100幅由相机直接拍摄到的原图,使用Labelme标注原图中根盒玻璃面部分,制作数据集用于训练HarDNet(Harmonic densenet)网络[30],使用训练后的HarDNet网络分割原图中玻璃面,得到分割后的掩膜图。将掩膜图与原图相乘,利用透视变换算法矫正,将原本倾斜、畸变的图像变换为在平行视角下观察的图像,图像相对大小和间距更接近实际。
(2)图像增强:DPED(DSLR photo enhance-ment dataset)[31]是一个用于图像增强的数据集,包含成对的低质量手机图像和高质量DSLR图像,通过在卷积神经网络中融合多种loss函数,包括content loss、textures loss、color loss和total variation loss,有效地对图像质量进行评估,实现纹理增强、颜色增强、内容增强和细节增强。本研究直接使用文献[31]在GitHub上传的基于DPED训练的增强网络预训练模型对根系图像进行增强。
1.3.2 基于SegFormer网络的根系分割
由于根系形态复杂,土壤存在颗粒噪声,传统的分割方法难以满足根系分割的需求。SegFormer[32]是一种用于语义分割任务的深度学习模型,通过自注意力机制在图像中建立全局关系,允许网络同时关注图像中的多个位置,并学习到丰富的特征表示。SegFormer网络引入了局部特征提取分支和全局特征提取分支,以平衡全局和局部信息,这种设计使得SegFormer网络能够在大尺度图像中准确地捕捉到细节信息,同时保持对整体上下文的认知。小麦根系较细且形态复杂,SegFormer网络能有效地捕捉图像中的相关特征,提高分割的准确性和鲁棒性,是分割小麦根系的有力工具。
为进一步提高SegFormer模型在根系分割中的性能,选择MiT-B2作为主干网络,MiT-B2网络具有较低的计算复杂度和参数量,并保持了良好性能,使得模型更易于训练和调优。损失函数采用交叉熵损失函数。模型训练环境为Windows 10操作系统,显卡RTX 2070 8 GB,处理器Intel(R) Core(TM) i7-8700 3.20 GHz,PaddlePaddle版本为2.4.2,cuda 10.2,cudnn 7.6.5;超参数设为2,迭代次数为30 000,学习率为0.000 6,图像尺寸为512像素×512像素。本研究共标注230幅数据集,训练后得到的模型平均交并比(MIoU)为0.808 3。
1.3.3 基于目标检测和沙漏注意力网络的断根修复
土培根盒法中,根系在生长过程中并非完全贴着根盒玻璃面生长,有一部分根系长在土壤内侧,贴着玻璃面生长的根系可以被直接观测,但生长在土壤内侧的根系则会被土壤遮挡,导致获取到的根系图像存在断根现象,根系分割后断根仍存在,影响表型信息的精确测量,需要对断根进行修复。
现有的图像修复算法包括传统的图像修复算法和基于深度学习的图像修复算法。传统的图像修复算法在邻域搜索方面取得了巨大突破,但由于其根据现有图像中已有信息生成补丁,当图像复杂时,传统方法难以生成与原图语义结构一致的修复结果[33]。基于深度学习的图像修复算法不仅可以生成语义一致且视觉合理的修复结果,同时可以修复较大面积缺失和更复杂的破损图像[34]。但现有基于深度学习的图像修复方法大多是直接输入待修复图像,一定程度上限制了修复精度。本文设计了一种先基于目标检测网络YOLO v7[35]对断根目标进行检测,再根据断根目标框裁剪局部图像,基于沙漏注意力网络(Hourglass attention network,HAN)[36]对断根局部图像进行修复,然后覆盖至原图的修复流程,以提高根系修复的精度。
1.3.3.1 基于YOLO v7的断根检测
随机选取300幅根系生物量差异较大的根系分割图,使用图像标注软件Labelme标注分割图的断根位置,将训练集图像及对应的标注文件输入到目标检测网络中训练,得到断根目标检测模型。
1.3.3.2 基于沙漏注意力网络的断根修复
沙漏注意力网络(HAN)是一种基于卷积神经网络的图像修复模型,可以用于修复根系图像中由土壤遮蔽引起的断根问题。该模型构建了一种沙漏形状的注意力结构,挖掘分层特征中的上下文信息,为重建图像生成合适的特征映射,与卷积相比,注意力模块具有更低的归纳偏置,能够根据实际输入生成不同的权重,从而使其更适合用于修复任务中具有多个破损的图像。本研究中不同图像中根系的断裂程度、位置及数目差异较大,非常适合利用HAN网络进行根系修复。
HAN网络的损失函数由4部分组成,分别为L1损失、感知损失、风格损失和对抗性损失,计算公式为
Lall=αLre+βLprec+γLstyle+λLadv
(1)
式中 Lall——HAN网络损失函数
Lre——L1损失
Lprec——感知损失
Lstyle——风格损失
Ladv——对抗性损失
α、β、γ、λ——超参数
结合根系图像特征对超参数进行修改,通过实验实际结果验证,将α、β、γ、λ分别设置为10、0.1、1、10。
在训练断根修复模型时,需要完整、无遮挡的根盒培养作物根系图像,因此需要人工修复根盒培养作物根系图像来作为训练集,但根系结构复杂,人工修复非常耗时耗力。针对这一问题,本研究通过使用水培法培养作物,获得完整、无遮挡的根系图像,作为沙漏注意力网络的训练集。考虑到培养介质的不同,采用二值图修复的方式,降低不同介质对修复的影响,这种处理方式无需人工标注即可获取HAN的训练集,从而大大降低人工成本。具体地,使用水培法培育小麦,在暗箱中安装LED光源,通过固定位置的彩色相机拍摄水培根盒,采集2 542幅根系时序RGB图像,使用SegFormer模型分割图像获得完整的根系二值图。使用最小外接矩形裁剪水培根系分割图,去除无关背景。裁剪256像素×256像素、512像素×512像素和1 024像素×1 024像素共3种尺寸下的局部根系图像,构成一个包含了不同分形结构、不同复杂程度、不同区域大小的多尺度局部根系图像训练集,从而让训练得到的根系修复模型有更好的鲁棒性。将训练集图像统一下采样为256像素×256像素,输入沙漏注意力网络,随机遮挡局部图像进行训练,训练至损失值趋于稳定后,取其中损失值最低时的模型作为断根修复模型。
原始的HAN模型是一次性修复的待修复图像,难以适应不同断裂程度的根系图像的修复。本研究提出了一种自适应的断根修复方法,计算修复前后根系二值图的像素差,与设定阈值比较,若像素差小于阈值,则终止修复,输出当前图像作为最终结果;若像素差大于阈值,则将修复后的图像输入断根检测模型,迭代上述修复过程,直至像素差小于设定的阈值,或达到设定的最大迭代次数,便终止修复,输出当前图像作为最终结果。该方法提高了对不同断裂程度根系的修复精度,并提高了算法的鲁棒性。
具体修复流程见图3,将分辨率为2 024像素×3 400像素的根系分割图像输入基于YOLO v7的断根目标检测模型,检测根系二值图中的断根,获得断根目标框。遍历根系图像中的断根目标框,以断根目标框中心为中心裁剪尺寸为1 024像素×1 024像素局部断根图像,统一下采样为256像素×256像素,输入到基于沙漏注意力网络的断根修复模型进行断根修复,该方法能包含更多上下文信息,提高根系修复精度。最后将修复后的断根局部图像通过超分辨模型放大至原始尺寸,得到断根修复结果。
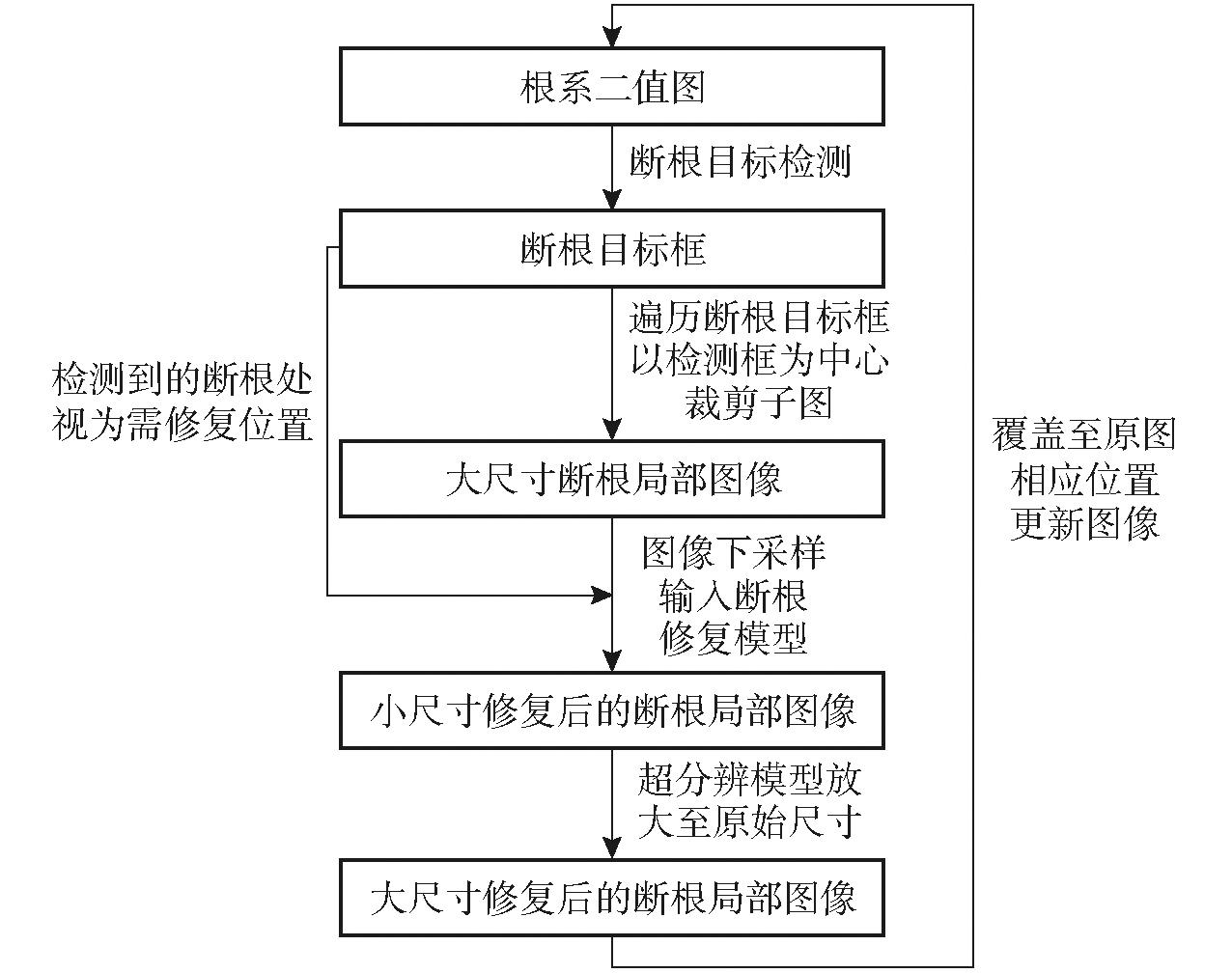
图3 断根修复流程图
Fig.3 Flow chart of root repair
经过以上图像处理后,部分二值图仍存在一些孤岛像素与不连通区域,需要进行图像的后处理。本研究通过形态学开运算和闭运算去除噪声、平滑边缘与填充空洞,提高二值图的质量。
基于图像处理后得到的根系二值图,提取6个根系表型特征,包括根面积、总根长、根深、根宽、根宽深比和根密度。各根系表型特征定义及示意图见表2和图4。
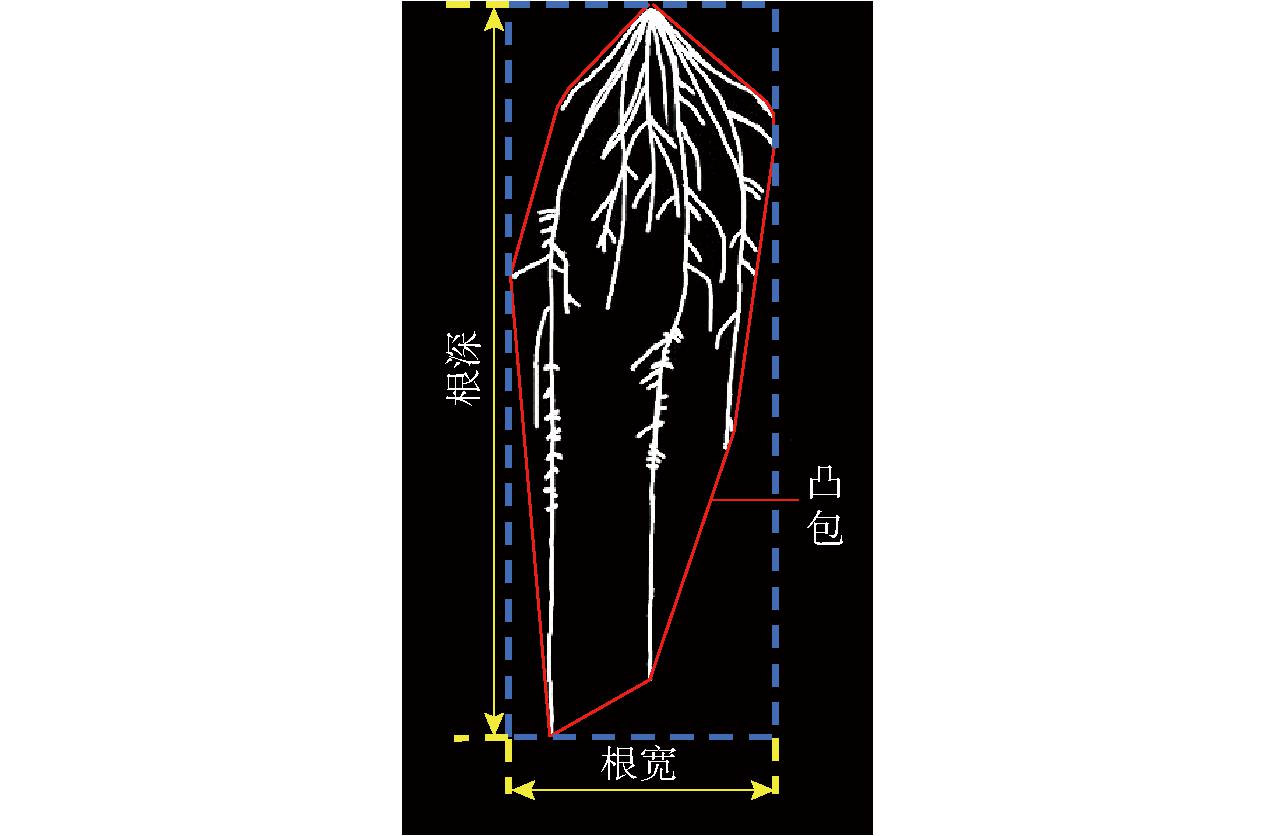
图4 根系表型特征示意图
Fig.4 Phenotypic characteristics schematic of root system
表2 根系表型特征简述
Tab.2 Brief description of root phenotypic characteristics

表型特征描述说明根面积根系分割图中所有像素点数量反映根系生物量总根长根系骨架化后像素点数量根系总长度根深竖直方向两端像素点的距离根系在土壤中的扎根深度根宽水平方向两端像素点的距离根系宽度根宽深比根系宽度与根系深度比反映根系总体形态根密度根系面积与根系凸包面积比反映根系分布紧凑程度
2.1.1 不同土壤基质对根系成像的影响
根盒土培环境下观测小麦根系表型,涉及不同土壤类型对成像效果的影响。基质探索的目的是寻找出既能满足小麦根系的成像观测条件又能让小麦正常生长的基质。
常见的土壤类型有砂质土、黏质土和壤质土,不同土壤影响着渗水速度和根系的透气性,从而影响根盒玻璃面观测效果,故设计预实验对根盒小麦根系在不同基质下的成像效果进行探索。使用的基质包括中国科学院遗传与发育生物学研究所农业资源研究中心的大田低氮壤土、华中农业大学作物表型平台的循环实验用土、黑土、砂土和草木灰等。探索了单一基质灌入根盒和不同基质相同比例均匀混合类型灌入根盒的两类方案的成像效果。
图5展示了预实验中得到的根盒图像,由图5可知,低氮壤土(图5a)和等体积混合的普通土与砂土(图5f)种植条件下,根系贴壁生长效果差,导致根系可观测性差;东北黑土(图5b)由于养分充足,根系成像效果较好;华中农业大学表型平台实验室普通土(图5c)中的根系偏细,且背景颗粒感明显,影响后期根系分割精度;等体积混合的低氮壤土与砂土(图5d)成像效果较好;等体积混合的低氮壤土与草木灰(图5e)种植条件下,根系出现聚集生长。由于东北黑土价格偏贵,经济性不如低氮壤土与砂土,且低氮壤土与砂土混合作为基质能应用于氮胁迫实验,兼顾了实用性和低成本。故后期实验使用低氮壤土和河砂(砂质土)按照体积比1∶1均匀搅拌后压实灌入,作为实验用基质。

图5 不同土壤基质下的根系成像效果图
Fig.5 Imaging effects of root system under different soil substrates
2.1.2 根盒倾斜角对根系成像的影响
比较了根盒倾斜角(根盒与水平面的夹角)为45°和30°两种情况下的根系成像效果,如图6所示。通过根系图像对比,发现倾斜角30°下的根系具有更好的成像效果,根系能够较好地贴着玻璃面生长,在玻璃面形成较完整的根系图像,故选取倾斜角30° 作为实验倾斜角。

图6 根盒不同倾斜角下的根系成像效果图
Fig.6 Root imaging effects under different root box inclination angles
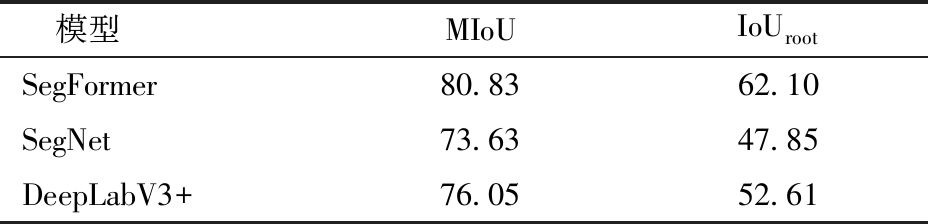
本研究对比SegFormer、SegNet[37]和DeepLabV3+[38]3种语义分割模型在小麦根系分割任务中的表现。训练模型使用相同的数据集,并以平均交并比(MIoU)和根系类别交并比(IoUroot)作为评价指标。
表3展示了3种模型在根系分割上的性能。由表3可知,SegFormer在小麦根系分割任务中的MIoU较SegNet和DeepLabV3+分别高7.20、4.78个百分点,IoUroot较SegNet和DeepLabV3+分别高14.25、9.49个百分点。这表明SegFormer语义分割模型在小麦根系分割方面具备明显的性能优势。基于Transformer架构的MiT-B2主干网络能够充分利用自注意力机制捕捉图像特征之间长距离依赖关系,从而在处理复杂图像数据时更全面地考虑全局上下文关系,很适合用于小麦根系图像分割。
表3 不同分割模型分割精度对比
Tab.3 Comparison of segmentation accuracy of different segmentation models %
模型MIoUIoUrootSegFormer80.8362.10SegNet73.6347.85DeepLabV3+76.0552.61
通过融合目标检测网络和沙漏注意力网络的断根检测-修复两阶段方法,实现了根系断根修复。图7为2个不同品种小麦根系修复方案效果。其中,图7c展示了本研究的两阶段根系修复方法的根系修复效果,即先进行断根检测,然后以断根检测目标框的中心为中心裁剪尺寸为1 024像素×1 024像素的子图,降采样至256像素×256像素后进行断根修复,最后超分辨至1 024像素×1 024像素。为了验证本研究方案的有效性,比较了断根检测-修复两阶段法中在修复阶段直接裁剪以断根目标检测框为中心的256像素×256像素局部断根图像进行修复的方案,结果见图7d。结果表明,本研究提出的两阶段断根修复方案能够实现较高精度的断根修复效果,而直接裁剪以断根目标检测框为中心的256像素×256像素局部断根图像进行两阶段修复,图7d的方式缺少足够的上下文信息,会影响修复结果。另外,为了验证断根检测-修复两阶段修复方案的有效性,研究还比较了直接使用沙漏注意力网络进行单阶段修复,不进行断根检测的修复结果(图7e),其中,由于原始根系图像尺寸较大,单阶段修复时先将原始图像裁剪为1 024像素×1 024像素的子图,下采样至256像素×256像素后由沙漏注意力网络进行修复,再超分辨至1 024像素×1 024像素。由图7可知,直接使用沙漏注意力网络进行单阶段修复会生成不存在的侧根(图7e),且对于部分断根区域无法进行修复,总体上修复效果较差。另外,本研究分析比较了不同图像修复算法的根系修复性能。图7f展示了基于快速行进方法的图像修复技术[39]修复断根的结果,由图7f可知,传统根系修复方法不适用于复杂结构断根的修复。本研究还比较了另一种基于深度学习的图像修复网络(递归特征推理网络RFR-Net[40])的断根修复效果。该网络能够结合上下文信息、递归推断修复图像,从图像待修复区域的边界开始修复,将修复部分作为已知内容,再对下一层待修复区域边界进行修复,直至图像待修复区域被递归修复完全。在测试断根修复能力时,将HAN替换为RFR-Net,同样结合断根检测-修复两阶段方法,获得修复结果,由图7g可知,其修复效果比沙漏注意力网络差。
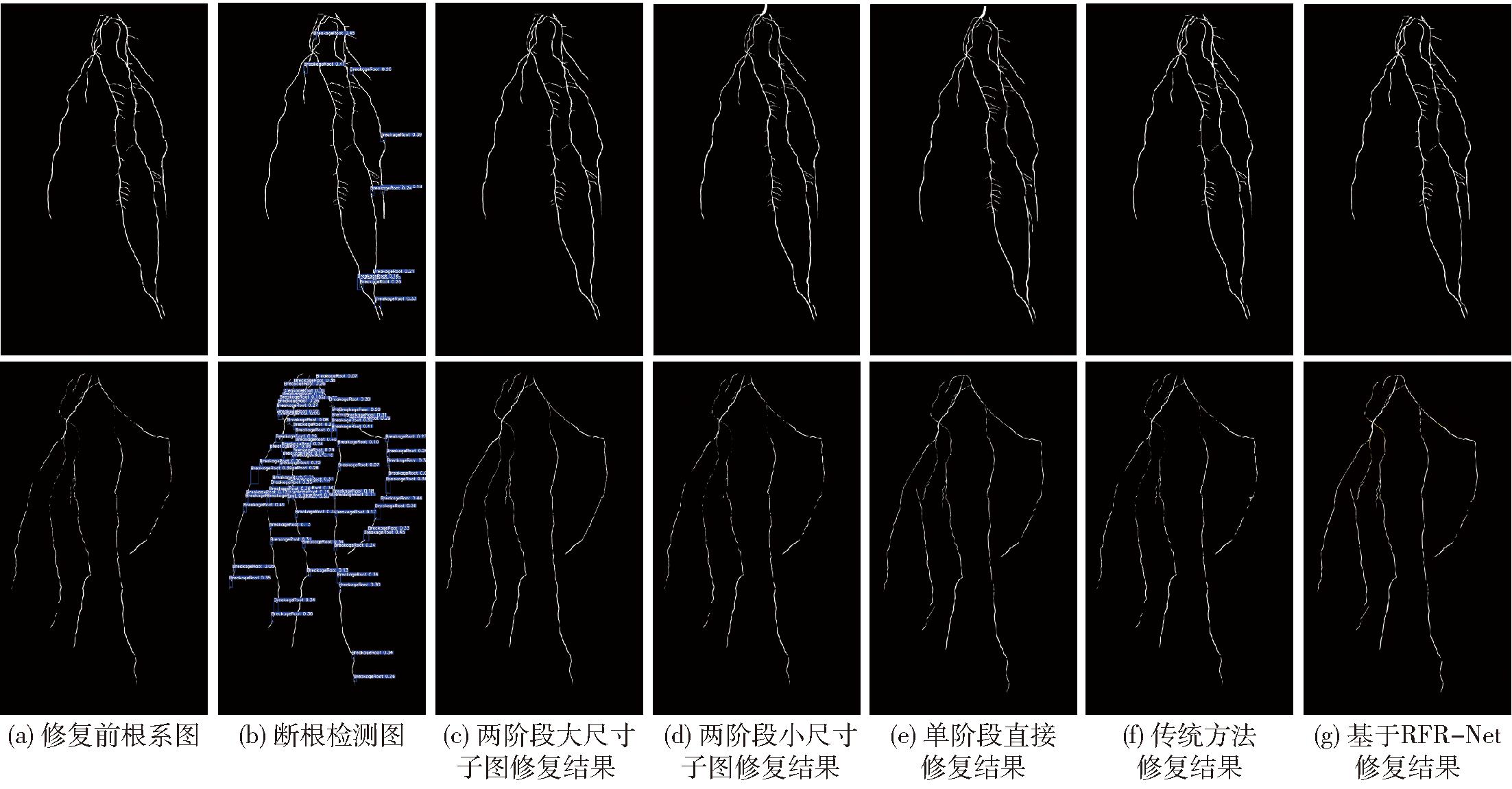
图7 2个代表性小麦品种的断根位置检测与修复结果图
Fig.7 Results of root break location detection and repair of two different wheat varieties
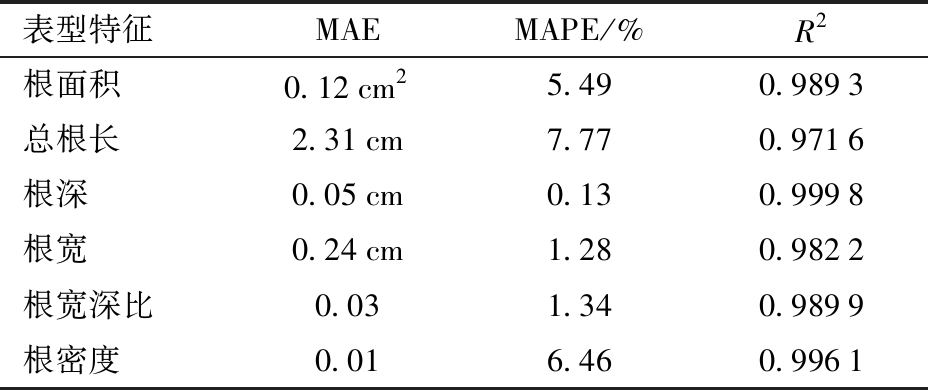
为评估小麦根系表型特征的测量精度,随机选取60幅小麦根系图像,并对图像进行人工标注,计算其表型特征数据作为小麦根系表型真实值,并与本研究提取的根系表型估测值进行对比,计算了3个常用的评估指标:平均绝对误差(MAE)、平均绝对百分比误差(MAPE)和决定系数R2,结果见表4。
表4 根系表型特征精度对比
Tab.4 Precision comparison of root phenotypic characteristics
表型特征MAEMAPE/%R2根面积0.12cm25.490.9893总根长2.31cm7.770.9716根深0.05cm0.130.9998根宽0.24cm1.280.9822根宽深比0.031.340.9899根密度0.016.460.9961
由表4可知,本研究所采用的算法在处理图像并提取根系表型特征值方面表现出较高的准确度。
本研究提取18个时间点下的43份小麦品种根系在正常处理及干旱处理下的表型数据,包括根面积、总根长、根宽、根深、根宽深比和根密度。
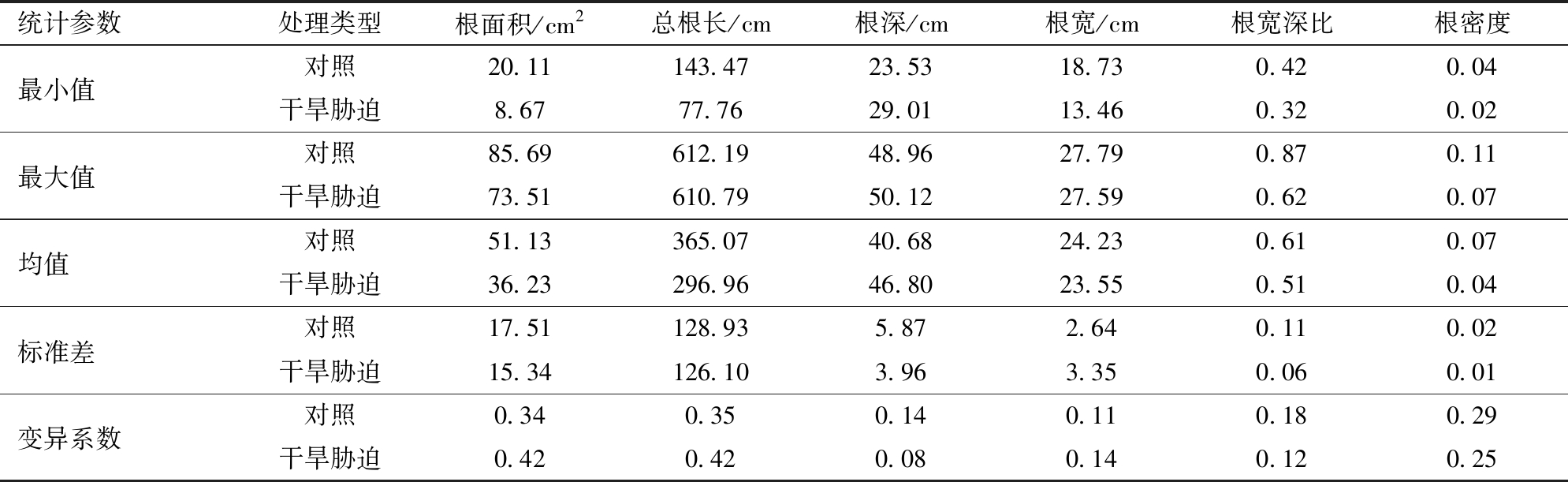
图8为从第11天(DAS11)至第65天(DAS65),共18个时间点的根系表型的时序变化情况。随着时间的推移,对照组与干旱胁迫组之间根系面积和总根长的差异逐渐增大,表明两组之间的根系生物量差异日益增大,小麦根系受到干旱胁迫其生物量小于对照组;对照组与干旱胁迫组的根系宽度较接近,但是干旱胁迫组的根系深度始终大于对照组,根系宽高比始终小于对照组,表明干旱胁迫组根系向下扎根更深,其根系构型便于获取土壤更深处的水分;从根系密度来看,干旱胁迫组的根系密度小于对照组,表明在水分胁迫下,小麦根系的生长受到了抑制,且根系分布更为分散,有利于水分吸收。表5为实验最后1天(DAS65)的根系表型数据统计结果。

图8 根系表型指标时序变化趋势
Fig.8 Temporal changes of root phenotypic index data
表5 DAS65干旱处理与对照处理下的根系表型参数
Tab.5 Difference of root phenotype between DAS65 drought treatment and control treatment
统计参数处理类型根面积/cm2总根长/cm根深/cm根宽/cm根宽深比根密度最小值对照20.11143.4723.5318.730.420.04干旱胁迫8.6777.7629.0113.460.320.02最大值对照85.69612.1948.9627.790.870.11干旱胁迫73.51610.7950.1227.590.620.07均值对照51.13365.0740.6824.230.610.07干旱胁迫36.23296.9646.8023.550.510.04标准差对照17.51128.935.872.640.110.02干旱胁迫15.34126.103.963.350.060.01变异系数对照0.340.350.140.110.180.29干旱胁迫0.420.420.080.140.120.25
图9为对干旱胁迫组和对照组在不同时间点的主成分分析结果,其中横纵坐标分别为第1主成分值(PC1)和第2主成分值(PC2),括号里的百分比表示对应主成分的贡献率。由图9可知,随着时间的推移,干旱胁迫组与对照组的分群效果逐渐变大,说明根系受到干旱胁迫后,表型特征发生了变化。
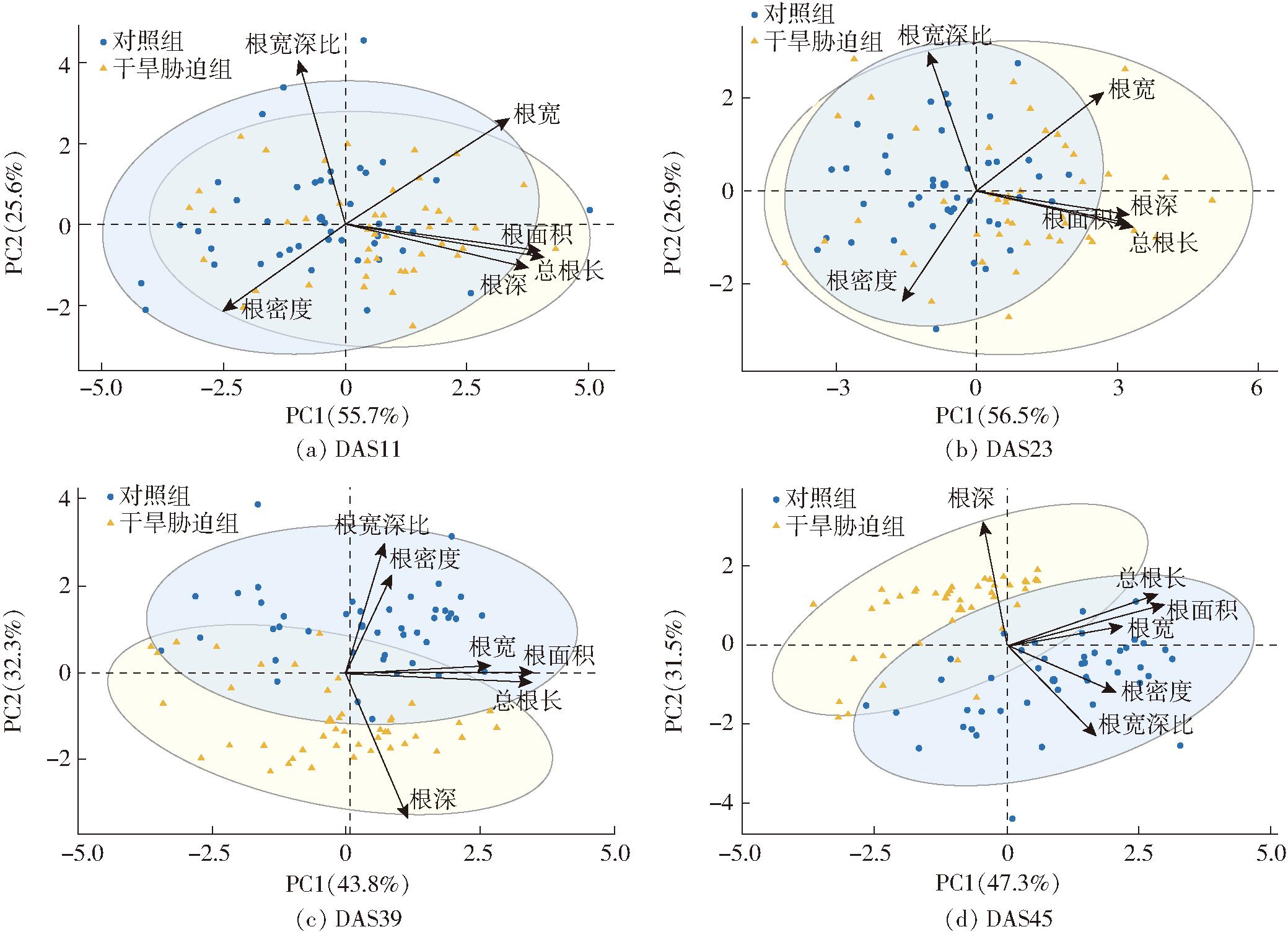
图9 干旱胁迫与对照组根系表型的主成分分析结果
Fig.9 Principal component analyses of root phenotype between drought stress and control group
为了分析不同品种的抗旱性能,根据不同品种根系表型在干旱胁迫和对照处理下的表现,计算其干旱胁迫耐受性指数(Stress tolerance indices,STI)[41],计算方法[42-43]为
(2)
式中 STI——干旱胁迫耐受性指数
Ys——干旱胁迫下表型指标
Yp——对照条件下表型指标
Yms——干旱胁迫下表型指标平均值
Ymp——对照条件下表型指标平均值
由于多指标易造成筛选过程复杂化,所以运用主成分分析法对6个根系表型特征的STI值进行特征压缩。表6为STI值主成分分析结果,前3个主成分累计贡献率超过98%,其中第1主成分(PC1)、第2主成分(PC2)和第3主成分(PC3)分别解释了47%、26%和25%的方差,因此,取前3个主成分进行品种抗旱性分析。
表6 DAS65根系各指标STI值的主成分分析结果
Tab.6 Results of principal component analysis of STI values of DAS65 root indexes
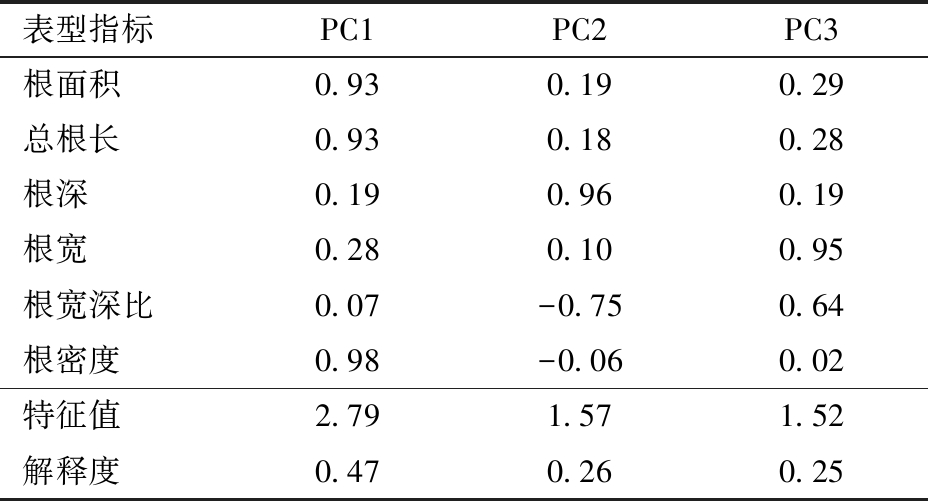
表型指标PC1PC2PC3根面积0.930.190.29总根长0.930.180.28根深0.190.960.19根宽0.280.100.95根宽深比0.07-0.750.64根密度0.98-0.060.02特征值2.791.571.52解释度0.470.260.25
为了更好地呈现数据结果,利用排名前3的STI综合得分主成分结果作三维图,如图10所示(坐标的3个维度上分布的点表示小麦品种。红点和蓝点分别表示STI排名前3和后3的小麦品种。其中,红线“1”表示根面积,红线“2”表示总根长,红线“3”表示根深,红线“4”表示根宽,红线“5”表示根宽深比,红线“6”表示根密度)。
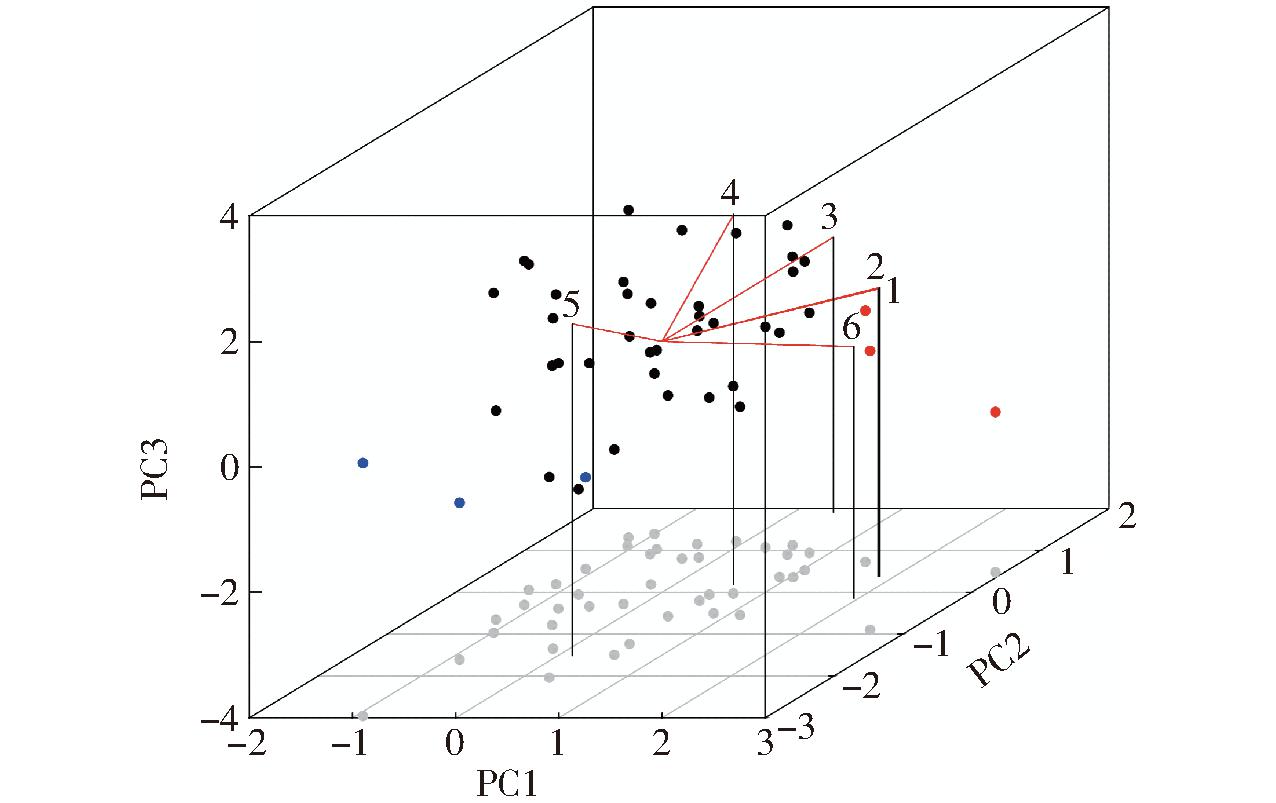
图10 STI综合得分主成分分析结果
Fig.10 Principal component analysis (PCA) for STI comprehensive scores
干旱胁迫耐受性指数综合得分(Stress tolerance index composite score,STICS)又称STI综合得分,是一种用于评估生物体在面对胁迫因素时的整体耐受能力的综合指标,它通过将每个小麦品种的PC值与对应的解释度加权平均计算得出,计算公式为
STICS=∑PCiAi
(3)
式中 STICS——干旱胁迫耐受性指数综合得分
PCi——小麦品种第i个主成分值
Ai——第i个主成分解释度
按照STI综合得分对本研究中的43个小麦品种的抗旱能力进行评估,排序前3的小麦品种为W009、W013和SW054-4;排名后3的品种为W020 X-037、W022 X-040、W019。
(1)探索确定了由等体积混合的低氮壤土和砂土作为根盒的土壤基质,在根盒作物培育系统装备了水肥一体化自动灌溉系统和抗旱大棚,对43个小麦品种进行了为期65 d的根盒小麦培育,分为干旱胁迫处理和对照处理。时序地采集了根系图像,实验共获得18个时间点、共计3 096幅根系图像。
(2)设计了一套基于土培根盒法的小麦根系图像处理与分析流程,通过深度学习技术实现了图像预处理、根系分割、断根检测和断根修复等。其中,针对由于土壤基质遮蔽部分根系引起的断根问题,设计了一种先对断根目标进行检测、再基于断根目标框裁剪局部图像进行修复,即融合了目标检测网络和沙漏注意力网络的检测-修复两阶段断根修复方法,并引入多尺度训练和自适应迭代法,提高了修复精度和鲁棒性。其中,沙漏注意力网络模型的训练集使用了不存在根系遮蔽问题的水培根盒法的根系。
(3)提取了43个小麦品种在两种不同处理下的根面积、总根长、根深等6个根系表型特征并进行解析,结果表明,小麦根系受到干旱胁迫时,根系生物量和构型发生了改变,表现为更少的根系生物量、更深的根系扎根深度及更分散的根系构型。因此,干旱胁迫会抑制小麦根系的生长,小麦也会调整根系的结构以适应水分限制。
[1] PIAO S, CIAIS P, HUANG Y, et al. The impacts of climate change on water resources and agriculture in China[J]. Nature,2010,467(7311):43-51.
[2] CURTIS T, HALFORD N. Food security:the challenge of increasing wheat yield and the importance of not compromising food safety[J].The Annals of Applied Biology,2014,164(3):354-372.
[3] 周应恒,李娜.“大食物观”与我国食物安全保障新思路[J].中国农业大学学报(社会科学版),2023,40(4):147-158.ZHOU Yingheng, LI Na. All-encompassing approach to food and new thinking of food security[J]. Journal of China Agricultural University(Social Sciences),2023,40(4):147-158. (in Chinese)
[4] 李剑,赵常玉,张富生, 等. LEA蛋白与植物抗逆性[J].植物生理学通讯, 2010,46(11):1101-1108.LI Jian, ZHAO Changyu, ZHANG Fusheng, et al. LEA protein and plant stress tolerance[J]. Plant Physiology Journal,2010,46(11):1101-1108. (in Chinese)
[5] 周晓果,景蕊莲,郝转芳,等.小麦幼苗根系性状的QTL分析[J].中国农业科学,2005,38(10):1951-1957.ZHOU Xiaoguo, JING Ruilian, HAO Zhuanfang, et al. Mapping QTL for seedling root traits in common wheat[J]. Scientia Agricultura Sinica,2005,38(10):1951-1957. (in Chinese)
[6] 陈兆波.生物节水研究进展及发展方向[J].中国农业科学,2007,40(7):1456-1462.CHEN Zhaobo. Research advance and development trends of water use efficiency in plant biology[J]. Scientia Agricultura Sinica,2007,40(7):1456-1462. (in Chinese)
[7] LAMBERS H, SHANE M W, CRAMER M D, et al. Root structure and functioning for efficient acquisition of phosphorus: matching morphological and physiological traits[J]. Annals of Botany, 2006, 98(4):693-713.
[8] HODGE A, BERTA G, DOUSSAN C, et al. Plant root growth, architecture and function[J]. Plant and Soil, 2009, 321(1):153-187.
[9] BAO Y, AGGARWAL P, ROBBINS N E, et al. Plant roots use a patterning mechanism to position lateral root branches toward available water[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(25): 9319-9324.
[10] GIEHL R F, VON W N. Root nutrient foraging[J]. Plant Physiology,2014,166(2):509-517.
[11] JACKSON R B, CANADELL J G, EHLERINGER J R, et al. A global analysis of root distributions for terrestrial biomes[J]. Oecologia,1996,108(3):389-411.
[12] LYNCH J P. Steep, cheap and deep: an ideotype to optimize water and N acquisition by maize root systems[J]. Annals of Botany, 2013,112(2):347-357.
[13] WARREN J M, HANSON P J, IVERSEN C M, et al. Root structural and functional dynamics in terrestrial biosphere models—evaluation and recommendations[J]. New Phytologist, 2015,205(1):59-78.
[14] KOEBERNICK N, DALY K R, KEYES S D, et al. High-resolution synchrotron imaging shows that root hairs influence rhizosphere soil structure formation[J]. New Phytologist, 2017,216(1):124-135.
[15] MA Z Q, GUO D L, XU X L, et al. Evolutionary history resolves global organization of root functional traits[J]. Nature, 2018, 555(7694):94-97.
[16] TOPP C N, BRAY A L, ELLIS N A, et al. How can we harness quantitative genetic variation in crop root systems for agricultural improvement[J]. Journal of Integrative Plant Biology,2016,58(3):213-225.
[17] MORRIS E, GRIFFITHS M, GOLEBIOWSKA A, et al. Shaping 3D root system architecture[J]. Current Biology, 2017,27(17):919-930.
[18] LYNCH J P. Roots of the second green revolution[J]. Australian Journal of Botany, 2007,55(5):493-512.
[19] CHARLES H, GODFRAY J, BEDDINGTON J, et al. Food security: the challenge of feeding 9 billion people[J]. Science, 2010, 327(5967):812-818.
[20] TESTER M, LANGRIDGE P. Breeding technologies to increase crop production in a changing world[J]. Science, 2010, 327(5967):818-822.
[21] BARLOW P W, PHIL D. Plant roots: the hidden half[J]. Environmental and Experimental Botany, 1992,32(4):513-515.
[22] DAS A, SCHNEIDER H M, BURRIDGE J, et al. Digital imaging of root traits (dirt): a high-throughput computing and collaboration platform for field-based root phenomics[J]. Plant Methods, 2015,11(1):51-63.
[23] BURRHERSEY J E, MOONEY S J, BENGOUGH A G, et al. Developmental morphology of cover crop species exhibit contrasting behaviour to changes in soil bulk density, revealed by X-ray computed tomography[J]. PLOS ONE, 2017,12(7):1-18.
[24] 崔喜红,陈晋,关琳琳.探地雷达技术在植物根系探测研究中的应用[J].地球科学进展,2009,24(6):606-611.CUI Xihong, CHEN Jin, GUAN Linlin. The application of ground penetrating radar to plantroot system detection[J].Advances in Earth Science,2009,24(6):606-611. (in Chinese)
[25] IYER-PASCUZZI A S, SYMONOVA O, MILEYKO Y, et al.Imaging and analysis platform for automatic phenotyping and trait ranking of plant root systems[J].Plant Physiology,2010,152(3):1148-1157.
[26] CLARK T R, MACCURDY B R, JUNG K J, et al. Three-dimensional root phenotyping with a novel imaging and software platform[J]. Plant Physiology,2011,156(2):455-465.
[27] 史建伟,于水强,于立忠,等.微根管在细根研究中的应用[J].应用生态学报,2006,17(4):4715-4719.SHI Jianwei, YU Shuiqiang, YU Lizhong, et al. Application of minirhizotron in fine root studies[J]. Chinese Journal of Applied Ecology,2006,17(4):4715-4719. (in Chinese)
[28] BASSEY B,SAMADI N,PANAHIFAR A, et al. Crossover artifact in X-ray focusing imaging systems: K-edge subtraction imaging[J].Nuclear Inst. and Methods in Physics Research,2018,910:26-34.
[29] DANIEL W V, ROBERT H, JI
 F. Light sheet fluorescence microscopy of plant roots growing on the surface of a gel[J]. Journal of Visualized Experiments,2017(119):55044.
F. Light sheet fluorescence microscopy of plant roots growing on the surface of a gel[J]. Journal of Visualized Experiments,2017(119):55044.
[30] CHAO P,KAO C,RUAN Y, et al. HarDNet: a low memory traffic network[C]∥Proceedings of the IEEE International Conference on Computer Vision, 2019:3552-3561.
[31] IGNATOV A,KOBYSHEV N,TIMOFTE R, et al. Dslr-quality photos on mobile devices with deep convolutional networks[C]∥Proceedings of the IEEE International Conference on Computer Vision,2017:3277-3285.
[32] XIE E, WANG W, YU Z, et al. SegFormer: simple and efficient design for semantic segmentation with transformers[J]. Advances in Neural Information Processing Systems,2021,34:12077-12090.
[33] 李雪涛,王耀雄,高放.图像修复方法综述[J].激光与光电子学进展,2023,60(2):29-44.LI Xuetao, WANG Yaoxiong, GAO Fang. Review of image inpainting methods[J]. Laser &Optoelectronics Progress,2023,60(2):29-44. (in Chinese)
[34] 罗海银,郑钰辉.图像修复方法研究综述[J].计算机科学与探索,2022,16(10):2193-2218.LUO Haiyin, ZHENG Yuhui. Survey of research on image inpainting methods[J]. Journal of Frontiers of Computer Science and Technology,2022,16(10):2193-2218. (in Chinese)
[35] WANG C Y, BOCHKOVSKIY A, LIAO H Y M.YOLO v7: trainable bag-of-freebies sets new state-of-the-art for real-time object detectors[C]∥Proceedings of the IEEE Conference on Computer Vision and Pattern Recognition,2023:7464-7475.
[36] DENG Y, HUI S, MENG R, et al. Hourglass attention network for image inpainting[C]∥Proceedings of the 17th European Conference on Computer Vision (ECCV), 2022:483-501.
[37] BADRINARAYANAN V, KENDALL A, CIPOLLA R.SegNet: a deep convolutional encoder-decoder architecture for image segmentation[J].IEEE Transactions on Pattern Analysis and Machine Intelligence,2017,39(12):2481-2495.
[38] CHEN L, ZHU Y, PAPANDREOU G, et al. Encoder-decoder with atrous separable convolution for semantic image segmentation[C]∥Proceedings of the European Conference on Computer Vision (ECCV). Springer, Munich, 2018:801-818.
[39] TELEA A. An image inpainting technique based on the fast marching method[J]. Journal of Graphics Tools,2004,9:23-34.
[40] Ll J, WANG N,ZHANG L,et al.Recurrent feature reasoning for image inpainting[C]∥IEEE/CVF Conference on Computer Vision and Pattern Recognition.lEEE,2020:7760-7768.
[41] BRUNEL S, TEULAT-MERAH B, WAGNER M H, et al. Using a model-based framework for analysing genetic diversity during germination and heterotrophic growth of Medicago truncatula[J]. Annals of Botany,2009,103(7):1103-1117.
[42] BAHRAMI F, ARZANI A, KARIMI V. Evaluation of yield-based drought tolerance indices for screening safflower genotypes[J].Agronomy Journal,2014,106(4):1219-1224.
[43] PIRNAJMEDIN F, MAJIDI M M, GHEYSARI M. Root and physiological characteristics associated with drought tolerance in Iranian tall fescue[J].Euphytica,2015,202(1):141-155.